Professional Documents
Culture Documents
MAKALAH CRYPTOGAME-kikok
Uploaded by
Rifki Muhammad IqbalCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
MAKALAH CRYPTOGAME-kikok
Uploaded by
Rifki Muhammad IqbalCopyright:
Available Formats
MAKALAH CRYPTOGAMAE ALGAE COKLAT (PHAEOPHYTA) SEBAGAI SUMBER ALGINAT
Diajukan untuk memenuhi tugas salah satu mata kuliah Cryptogamae yang dibimbing oleh Bapak Dr. M. Agus Salim, Drs. MP.
Nama : Rifki Muhammad Iqbal NIM : 1211702067 Kelas/Semester : IV B
JURUSAN BIOLOGI FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS ISLAM NEGERI SUNAN GUNUNG DJATI BANDUNG 2013
KATA PENGANTAR
Puji syukur kehadirat Allah SWT, yang telah memberikan rahmat serta hidayah-Nya sehingga makalah ini dapat terselesaikan sesuai rencana yang ditentukan. Makalah ini disusun untuk memenuhi tugas kuliah yang diberikan yaitu mata kuliah Cryptogamae. Tersusunya makalah ini tidak terlepas dari berbagai pihak yang telah mendukung dan membantu, sehingga saya ucapkan terima kasih. Penulis berharap makalah ini bermanfaat bagi semua pembaca. Makalah ini masih jauh dari sempurna, maka dari itu penulis selalu mengharapkan kritik dan saran dari para pembaca. Atas kritik dan saran kami sampaikan terima kasih banyak.
Bandung, 6 Maret 2013
Penyusun
ii
DAFTAR ISI
Kata Pengantar ....................... i Daftar Isi ............................... ii BAB I PENDAHULUAN ......................... 1 1.1 . Latar Belakang ...........................1 1.2 Rumusan Masalah ...............................2 1.3 Tujuan ..........................................2 BAB II PEMBAHASAN ...................... 3 2.1 Komposisi Kimia Dunaliella sp .........................................................................................3 2.2 Ekstraksi Senyawa Antibakteri ....................................................................................4 2.3 Aktivitas Antibakteri ...................................................................................... 8 BAB III PENUTUP .................... 13 3.1 Kesimpulan ........................... 13 3.2 Saran ......................... 14 DAFTAR PUSTAKA ........................ 12
iii
BAB I PENDAHULUAN
1.1. Latar Belakang Keanekaragaman sumberdaya di perairan Indonesia merupakan kekayaan alam yang kemungkinan besar masih sangat sedikit dimanfaatkan oleh manusia. Wilayah perairan Indonesia mencapai sekitar 5,8 juta km2 serta mempunyai garis pantai yang panjangnya
sekitar 81.000 km, sehingga pemanfaatan sumberdaya laut selayaknya dilakukan secara optimal. Wilayah pesisir dan lautan Indonesia memiliki keanekaragaman hayati tertinggi di dunia. Tingginya keanekaragaman hayati di laut dapat merefleksikan potensi ekonomi perairan pesisir dan lautan tersebut, dalam artian bahwa semakin tinggi keanekaragaman hayati yang terkandung, semakin besar potensi yang dapat dikembangkan (Dahuri 2003). Mikroalga sebagai salah satu komoditi hasil perairan dewasa ini telah menjadi alternatif untuk dikembangkan karena memiliki potensi yang besar untuk dimanfaatkan. Mikroalga merupakan mikroorganisme atau jasad renik dengan tingkat organisasi sel termasuk dalam tumbuhan tingkat rendah. Mikroalga dikelompokkan dalam filum
Thallophyta karena tidak memiliki akar, batang, dan daun sejati, namun memiliki zat pigmen klorofil yang mampu melakukan fotosintesis. (Kabinawa 2001). Selain itu, air dan karbon dioksida dengan adanya energi surya dari matahari dan garam-garam hara dapat menghasilkan senyawa organik seperti karbohidrat. Karena kemampuannya membentuk zat organik dari zat anorganik, maka disebut sebagai produsen primer. (Nontji 1993). Seiring perkembangan bioteknologi mikroalga, sejumlah penelitian mulai ditujukan untuk menghasilkan produk bermanfaat yang bernilai tinggi diantaranya sebagai sumber bahan kimia yang dapat menghasilkan produk seperti gliserol, vitamin, protein, pigmen, enzim, dan bahan-bahan bioaktif lain. Bahan-bahan bioaktif yang telah diketahui dapat dihasilkan dari mikroalga yaitu antioksidan, toksin, bahan obat-obatan, dan zat pengatur pertumbuhan. (Kabinawa 1994). Aplikasi bioteknologi sumberdaya perairan berperan dalam mengetahui sekaligus menghasilkan bahan aktif termasuk antimikroba sehingga diperoleh bahan aktif yang dapat dimanfaatkan untuk manusia dan lingkungan. Spesies biota laut yang memiliki potensi
1
menghasilkan obat-obatan diperkirakan lebih dari 35.000 dan yang dimanfaatkan baru sekitar 5.000 spesies (Dahuri 2003). Jumlah yang besar tersebut seyogyanya dimanfaatkan
seoptimal mungkin. Potensi sumber daya alam terutama mikroalga belum banyak diungkap dan diteliti, sehingga informasi yang dapat diperoleh masih sangat terbatas. Penelitian
tentang aktivitas senyawa antibakteri dari mikroalga masih sedikit (Matsueda et al. 1988; Shklar dan Schwartz 1988 diacu dalam Chang et al. 1993). Berbagai hasil penelitian mengenai bahan aktif termasuk antimikroba dari mikroalga telah dilaporkan oleh para pakar. Pratt (1942) menemukan bahwa Chlorella sp. diketahui memiliki potensi sebagai antibakteri, Chlorella vulgaris mengandung zat antibakteri yang disebut chlorellin. (Hashimoto 1979 diacu dalam Indhira 2004). Dunaliella merupakan salah satu mikroalga yang cukup banyak diteliti terutama sebagai sumber -karoten dan gliserol. Pemanfaatan Dunaliella cukup beragam mulai dari sebagai makanan kesehatan seperti yang telah dipasarkan di negara-negara maju. Dunaliella salina juga dapat dimanfaatkan sebagai jasad pakan yang cukup baik (Isnansetyo dan
Kurniastuty 1995). Chang et al. (1993) telah melakukan pemurnian sebagian komponen antibiotik Dunaliella primolecta yang memiliki aktivitas antibiotik terhadap bakteri Staphylococcus aureus, Bacillus subtilis, Bacillus cereus, dan Enterobacter aerogenes.
Ekstrak Dunaliella tertiolecta menunjukkan hasil positif sebagai antibakteri (Becker 1994). 1.2.Rumusan Masalah 1.3.Tujuan Mengetahui komposisi kimia Dunaliella sp. Mendapatkan senyawa antibakteri dari berbeda. Mempelajari aktivitas antibakteri ekstrak Dunaliella sp. terhadap bakteri patogen. Dunaliella sp. pada umur panen yang Komposisi kimia apa yang terdapat pada Dunaliella sp? Bagaimana mendapatkan senyawa antibakteri dari Dunaliella sp? Bagaimana pengaruh antibakteri ekstrak Dunaliella sp terhadap bakteri patogen?
BAB II PEMBAHASAN 2.1. Komposisi Kimia Dunaliella sp. Kandungan kimia tiap mikroalga berbeda-beda yang dipengaruhi oleh zat hara, kondisi lingkungan seperti intensitas cahaya, lama pencahayaan, suhu, dan lain-lain. Kandungan kimia suatu mikroalga dapat dilihat dari kandungan protein, lemak, karbohidrat, vitamin, dan mineral. (Isnansetyo dan Kurniastuty 1995). Manfaat Dunaliella cukup beragam mulai dari sebagai antibakteri, jasad pakan yang cukup baik, sumber gliserol dan karoten hingga sebagai makanan kesehatan seperti halnya dengan Chlorella karena
kandungan proteinnya yang tinggi. Hasil analisis proksimat Dunaliella sp. dapat dilihat pada Tabel 1. Tabel 1. Komposisi kimia Dunaliella sp. Senyawa kimia Air Abu Protein Lemak Karbohidrat Jumlah (%) 65,22 6,17 18,12 1,60 8,89
Kandungan air, protein, lemak, abu, dan karbohidrat dari Dunaliella sp. adalah 65,22 %, 18,12 %, 1,60 %, 6,17 %, dan 8,89 %. Protein mempunyai peranan penting untuk pertahanan fungsi jaringan secara normal, perawatan jaringan tubuh, mengganti sel-sel yang rusak dan pembentukan sel-sel baru. Komponen penyusun protein adalah asam amino. Beberapa mikroalga dianggap sebagai sumber protein karena kandungannya yang tinggi seperti Chlorella vulgaris (35,30 %), Tetraselmis sp. (49,75 %), Dunaliella salina (57 %). (Isnansetyo dan Kurniastuty 1995). Kandungan protein Dunaliella sp. adalah 18,12 % dan asam amino menentukan kualitas protein. Pembentukan asam amino Dunaliella sp. diperoleh dari unsur hara yang terdapat pada medium tumbuhnya. Lemak merupakan sumber energi paling tinggi. Satu gram lemak dapat menghasilkan 9 kkal, sedangkan karbohidrat dan protein hanya menghasilkan 4 kkal/gram. (Winarno
3
1997). Lemak disusun atas beberapa asam lemak yang merupakan komponen pembentuk. Kandungan lemak Dunaliella sp. senilai 1,60%. Kualitas lemak pada Dunaliella sp. juga ditentukan oleh asam lemak pembentuknya. (Isnansetyo dan Kurniastuty 1995). Unsur hara dan faktor lingkungan dapat mempengaruhi kandungan asam lemak. Beberapa mikroalga seperti Dunaliella sp., Tetraselmis suecica akan menghasilkan kandungan lemak yang
rendah dan terus memproduksi karbohidrat bila lingkungannya terganggu. (Becker 1994). Abu adalah zat anorganik sisa hasil pembakaran suatu bahan organik. Kandungan abu dan komposisinya tergantung pada macam bahan dan cara pengabuannya. Kadar abu ada hubungannya dengan mineral suatu bahan. (Sudarmadji et al. 1989). Kandungan abu yang dimiliki Dunaliella sp. sebesar 6,17 %. Peningkatan kadar abu seiring dengan meningkatnya kandungan mineral. Mineral berperan dalam menjaga tekanan osmosis, komponen penting pembentuk struktur tulang dan gigi, menjaga keseimbangan asam dan basa tubuh. karbohidrat Dunaliella sp. adalah 8,89 % yang dilakukan secara by difference. Kadar karbohidrat ini tergantung pada faktor pengurangannya yaitu kadar air, abu, protein dan lemak. Oleh karena itu, karbohidrat sangat dipengaruhi oleh kandungan zat gizi lainnya. Kandungan senyawa kimia Dunaliella sp. berkaitan dengan medium tumbuhnya. Medium tumbuh Dunaliella sp. yang digunakan dalam penelitian ini masih terdiri dari unsur teknis seperti pemakaian vitamin B12. Unsur hara dan faktor lingkungan seperti diketahui memiliki pengaruh terhadap kandungan senyawa Dunaliella sp. 2.2. Ekstraksi Senyawa Antibakteri Penelitian ini menggunakan pelarut heksana, etil asetat, metanol dalam mengekstrak senyawa antibakteri dari Dunaliella sp. Ekstraksi adalah suatu proses penarikan komponen yang diinginkan dari suatu bahan ataupun proses pemisahan satu atau beberapa zat yang diinginkan dari campurannya dengan bantuan pelarut. Pada fase log dihasilkan produk Kadar
metabolit primer yang dapat berpotensi sebagai antibakteri seperti asam lemak, polisakarida, dan golongan senyawa dipeptida. Komponen penyusun antibiotik dari alga diketahui terdiri dari asam lemak, asam organik, bromofenol, penghambat fenolat, tannin, terpenoid, polisakarida, alkohol (Metting dan Pyne 1986 diacu dalam Setyaningsih et al. 2000). Pada fase stasioner terjadi akumulasi produk toksik yang merupakan inhibitor (Mckane dan
Kandel 1985). Kultur Dunaliella sp. dipanen pada hari ke-7 yang mewakili fase log dan hari ke-14 yang mewakili fase stasioner.
Pemisahan biomassa sel dengan filtrat dilakukan menggunakan sentrifuse. Teknik pemisahan biomassa dan filtrat dengan menggunakan sentrifuse merupakan salah satu cara yang sangat efisien (Vonshak 1990). Mikroalga memiliki substansi organik yang berlimpah di dalam selnya yang disebut metabolit intraseluler, sedangkan produk yang diekskresikan ke medium tumbuhnya disebut metabolit ekstraseluler (Stewart 1974). Metabolit intraseluler tersebut terdapat pada biomassa sedangkan metabolit ekstraseluler terdapat pada filtrat. Biomassa dan filtrat dikeringbekukan untuk menghilangkan komponen air dan menghindari kerusakan komponen bioaktif yang terkandung dalam bahan. Pengeringan beku dilakukan dengan menggunakan freeze dryer pada suhu -75 C agar komponen bioaktif yang terkandung tidak rusak. Hasil dari proses pengeringan beku tersebut berupa filtrat dan biomassa kering. Filtrat dan biomassa kering Dunaliella sp. disajikan pada Gambar 13. Kemudian biomassa kering dilakukan proses pemecahan sel dengan menggunakan glass bead. Selanjutnya dilakukan pengadukan (stirring) menggunakan pengaduk magnet (magnetic stirrer) dengan tujuan memecah sel sehingga komponen yang diinginkan dapat keluar, memperbesar kemungkinan tumbukan antar partikel sehingga komponen yang telah keluar dapat terikat dan larut dalam pelarut, serta memperbesar pengikatan komponen dengan pelarut yang digunakan. Maserasi ini dilakukan secara terus menerus selama 24 jam untuk memperbesar kemungkinan reaksi antara senyawa yang diinginkan dengan pelarut. Tahap selanjutnya adalah evaporasi yang bertujuan menguapkan pelarut dan memperoleh senyawa hasil ekstraksi yang diinginkan. Penguapan pelarut ini dengan
menggunakan rotary evaporator vacuum pada suhu 35 C. Penggunaan rotary evaporator vacuum untuk memekatkan larutan dalam volume kecil sebaiknya menggunakan suhu antara 30-40 C agar komponen bioaktif yang terkandung tidak rusak. (Harborne, 1987). Ekstraksi pada penelitian ini dilakukan dengan menggunakan pelarut yang berbeda yang diawali dari pelarut heksana (pelarut non polar), kemudian pelarut etil asetat (pelarut semi polar), dan terakhir pelarut metanol (pelarut polar). Penggunaan berbagai pelarut ini dilakukan agar zat aktif yang terkandung dan belum diketahui sifatnya dapat terekstrak secara optimal sesuai kepolarannya. Berat ekstrak Dunaliella sp. dengan jenis pelarut dapat dilihat pada Tabel 2.
Berat biomassa kering yang dihasilkan pada umur panen fase stasioner (1,54 gram) lebih besar dibandingkan pada fase log (1,10 gram). Hal ini disebabkan oleh jumlah sel Dunaliella sp. pada fase stasioner lebih tinggi dibandingkan pada fase log, meskipun laju pertumbuhan pada fase stasioner mengalami penurunan. Jumlah sel pada fase stasioner cenderung tetap karena sel stelah mencapai titik jenuh. Tabel 2. Berat ekstrak Dunaliella sp. dengan jenis pelarut Berat biomassa basah Berat biomassa kering Rendemen ekstrak kering (%) 1,81 % 4,54 % 5,45 % 1,29 % 1,94 % 2,59 %
Umur panen
Volume (liter)
Jenis pelarut Heksana
Berat ekstrak 0,02 gram 0,05 gram 0,06 gram 0,02 gram 0,03 gram 0,04 gram
Fase log
10 liter
3,78 gram
1,10 gram
Etil asetat Methanol Heksana
Fase stasioner
10 liter
5,04 gram
1,54 gram
Etil asetat Methanol
Rendemen ekstrak kering pada fase log yang diperoleh dari ekstraksi dengan pelarut metanol (5,45 %) lebih besar dibandingkan dengan rendemen ekstrak dari ekstraksi pelarut etil asetat (4,54 %) dan pelarut heksana (1,81 %). Hal yang sama juga terjadi pada fase stasioner, dimana rendemen ekstrak kering yang dihasilkan dari ekstraksi dengan pelarut metanol (2,59 %) lebih besar dibandingkan rendemen ekstrak dari ekstraksi dengan pelarut etil asetat (1,94 %) dan juga pelarut heksana (1,29 %). Hal ini menunjukkan bahwa
Dunaliella sp. lebih banyak mengandung senyawa yang dapat larut dalam pelarut polar. Selain itu, pelarut metanol diketahui sebagai pelarut yang mampu mengekstraksi kelompok senyawa gula, asam-asam amino, glikosida, juga dapat melarutkan kelompok senyawa yang larut dalam petroleum eter, heksana, kloroform, etil asetat, etanol, air dalam jumlah dan proporsi berbeda-beda sehingga diperoleh hasil ekstraksi metanol cukup besar. (Houghton dan Raman 1998). Berat ekstrak-heksana, ekstrak-etil asetat, ekstrak-metanol yang diperoleh pada fase log berturut-turut nilainya adalah 0,02; 0,05; 0,06 gram. Pada fase log terjadi metabolisme primer dimana polisakarida, protein, lemak, dan asam nukleat merupakan produk metabolit
primer. Komponen-komponen tersebut merupakan penyusun utama suatu makhluk hidup (Manitto 1992). Berat ekstrak-heksana, ekstrak-etil asetat, ekstrak-metanol yang diperoleh pada fase stasioner berturut-turut nilainya adalah 0,02; 0,03; 0,04 gram. Pada fase stasioner terjadi metabolisme sekunder yang merupakan keseluruhan proses sintesis dan perombakan produk metabolit primer (Herbert 1995), terjadinya penumpukan produk beracun dan kehabisan nutrien (Pelczar dan Chan 2005), serta menghasilkan komponen-komponen yang berfungsi untuk pertahanan hidup . Produk senyawa metabolit sekunder seperti senyawa fenol, alkaloid, dan terpenoid. Ekstrak yang diperoleh dari proses ekstraksi Dunaliella sp. berbentuk pasta dengan warna yang berbeda-beda. Ekstraksi dengan pelarut heksana menghasilkan ekstrak-heksana berwarna coklat kekuningan, ekstraksi dengan pelarut etil asetat menghasilkan ekstrak-etil asetat berwarna kecoklatan, dan ekstraksi dengan pelarut metanol menghasilkan ekstrakmetanol berwarna hijau tua. Pelarut-pelarut yang digunakan dalam proses ekstraksi menghancurkan membran sel dan melarutkan pigmen yang terkandung dalam bahan sehingga menghasilkan warna tersebut (Shahidi dan Naczk 1995). Pelarut non polar misalnya heksana mampu mengekstrak
hidrokarbon, asam lemak, asetogenin, dan terpen. Pelarut semi polar misalnya etil asetat mampu mengekstrak senyawa fenol dan terpenoid. Pelarut polar misalnya metanol mampu mengekstrak senyawa alkaloid kuartener, komponen fenolik, karotenoid, dan tanin (Harborne 1987). Ekstrak-heksana yang berwarna kuning kecoklatan diduga karena kandungan
karotenoid. Karotenoid adalah pigmen berwarna kuning, jingga, atau merah yang terdapat di berbagai macam plastid berwarna (kromoplas) (Salisbury dan Ross 1995). Pigmen warna ini mudah diekstraksi dalam pelarut lipid seperti heksana, kloroform. Demikian juga ekstrak-etil asetat yang berwarna kecoklatan diduga karena kandungan karotenoid. Ekstrak-metanol yang berwarna hijau tua diduga disebabkan oleh klorofil yang terekstrak. Penelitian Sugiastuti (2002) mendapatkan ekstrak-etanol daun sirih berwarna hijau kehitaman yang juga disebabkan oleh kandungan klorofil dari daun sirih. Klorofil merupakan zat hijau daun yang penting dalam fotosintesis. (Salisbury dan Ross 1995). Hasil dari ekstraksi tahap awal ini masih berupa ekstrak kasar dan umumnya ekstraksi dengan pelarut tidak dapat menghasilkan komponen yang diinginkan secara sempurna kecuali
dilanjutkan dengan pemurnian.
2.3. Aktivitas Antibakteri Uji aktivitas antibakteri dilakukan terhadap bakteri Gram positif, yaitu
Staphylococcus aureus dan Bacillus cereus serta bakteri Gram negatif, yaitu Escherichia coli dan Vibrio harveyi. Pengujian ini dilakukan untuk mengetahui aktivitas antibakteri pada
ekstrak-heksana, ekstrak-etil asetat, ekstrak-metanol dari metabolit intraseluler (biomassa) dan metabolit ekstraseluler (filtrat). Kloramfenikol digunakan sebagai kontrol positif. Konsentrasi masing-masing ekstrak yang diteteskan pada paper disc adalah 300 g/disc. Optical Density (OD600) masing-masing bakteri adalah Staphylococcus aureus (0,64),
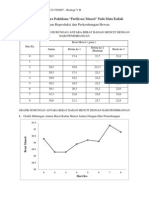
Bacillus cereus (0,68), Escherichia coli (0,65), dan Vibrio harveyi (0,67). Hasil uji aktivitas antibakteri ekstrak Dunaliella sp. disajikan pada Tabel 3. Ekstrak-heksana dan ekstrak-etil asetat menunjukkan adanya aktivitas antibakteri terhadap bakteri uji walaupun kemampuannya tergolong lemah. Besarnya aktivitas antibakteri ditunjukkan oleh besarnya zona bening yang terbentuk di sekitar paper disc. Ekstrak-metanol dan ekstraseluler tidak menunjukkan adanya aktivitas antibakteri. Tabel 3. Hasil uji aktivitas antibakteri Dunaliella sp. terhadap bakteri patogen Umur panen Ekstrak Diameter zona hambat (mm) pada bakteri uji S. aures Fase log Heksana Etil asetat Methanol Ekstraseluler Fase stasioner Heksana Etil asetat Methanol Ekstraseluler Kloramfenikol 3 2 2 2 19 B. cereus 4 2 2 3 20 E. coli 3 2 1 2 24 V. harveyi 5 3 4 4 26
Pengujian ekstrak-heksana pada fase log terhadap bakteri uji Staphylococcus aureus, Bacillus cereus, Escherichia coli, dan Vibrio harveyi menghasilkan diameter zona bening di sekitar paper disc berturut-turut sebesar 3, 4, 3, dan 5 mm. Diameter zona bening dari ekstrak-etil asetat dengan bakteri uji tersebut, berturut-turut adalah 2, 2, 2, dan 3 mm.
8
Berdasarkan diameter zona hambat yang dihasilkan, ekstrak-heksana dan etil asetat termasuk kategori yang memiliki aktivitas lemah (rata-rata diameter zona hambat < 5 mm). (Davis dan Stout 1971). Hasil uji aktivitas antibakteri ekstrak-heksana dan ekstrak-etil asetat pada fase stasioner terhadap bakteri uji Staphylococcus aureus, Bacillus cereus, Escherichia coli, dan Vibrio harveyi juga termasuk dalam kriteria lemah (rata-rata diameter zona hambat < 5 mm) dengan diameter zona hambat masing-masing sebesar 2, 2, 1, dan 4 mm, serta 2, 3, 2, dan 4 mm. Komponen aktif yang dapat diekstrak dari suatu bahan tergantung pada kepolaran pelarut yang digunakan. Senyawa yang terikat pada pelarut non polar misalnya heksana antara lain hidrokarbon, asam lemak, asetogenin, dan terpen. (Riguera 1997). Ekstrak-
heksana diduga mengandung asam lemak dan terpen. Beberapa jenis asam lemak bebas yang terbukti memiliki daya hambat antibakteri diantaranya linoleat, arakhidonat, linolenat
terhadap Clostridium welchii. (Kabara, 1983). Senyawa terpen contohnya triterpenoid merupakan golongan yang berpotensi sebagai antimikroba terutama banyak digunakan untuk menyembuhkan penyakit kulit. (Robinson 1995). Pelarut semi polar misalnya etil asetat mampu mengekstrak senyawa fenol dan terpenoid (Harborne 1987). Senyawa yang berperan sebagai antibakteri dalam ekstrak-etil asetat diduga adalah fenol dan terpenoid tersebut. Sejumlah komponen penyusun antibiotik dari alga laut diketahui diantaranya terdiri dari terpenoid dan penghambat fenolat. (Metting dan Pyne 1986 diacu dalam Setyaningsih et al. 2000). Kelompok fenolik merupakan aneka ragam senyawa yang terdiri dari fenol, asam fenolat, fenilpropanoid, pigmen flavonoid, antosianin, flavonol dan flavon, flavonoid kuinon. (Harborne 1987). Pelarut polar misalnya metanol mampu mengekstrak kelompok senyawa alkaloid kuartener, komponen fenolik, karotenoid, dan tanin. (Harborne 1987). Ekstrak-metanol pada penelitian ini tidak menunjukkan adanya aktivitas antibakteri. Hal ini dapat diduga bahwa senyawa aktif yang terdapat pada Dunaliella sp. adalah senyawa yang bersifar non polar dan semi polar. Selain itu, polaritas pelarut metanol berpengaruh terhadap aktivitas antibakteri. Hiserodt et al. (1998) diacu dalam Parhusip (2006) menyatakan bahwa polaritas suatu senyawa mempengaruhi aktivitas antibakteri seperti 6-gingerol yang mempunyai rantai alkil lebih polar daripada 10-gingerol memberikan penghambatan lebih rendah terhadap
9
minor, xanton, stilbena, tanin, serta pigmen
Mycobacterium avium. Hal ini menunjukkan bahwa senyawa polar seperti metanol juga cenderung mempunyai aktivitas antibakteri yang lebih rendah. Ekstraseluler tidak menunjukkan aktivitas antibakteri. Hal ini diduga bahwa metabolit ekstraseluler yang terdapat pada filtrat menguap karena perlakuan freeze drying dan pada penelitian ini, hasil ekstraseluler tidak dilakukan maserasi. Selain itu, Dunaliella sp. diduga tidak mensekresikan substansi organik yang berfungsi sebagai komponen aktif ke medium tumbuhnya. Ekstrak Dunaliella sp. yang dipanen pada umur 7 hari yang mewakili fase log dan umur 14 hari yang mewakili fase stasioner memiliki aktivitas antibakteri walaupun tergolong lemah. Senyawa antibakteri pada Dunaliella sp. dihasilkan pada fase log dan stasioner. Selama fase log dihasilkan produk metabolit primer seperti polisakarida, asam amino, asam lemak, gula, asetil koenzim, asam mevalonat, dan nukleotida. (Manitto 1992). Beberapa produk metabolit primer ini dapat berpotensi sebagai antibakteri seperti asam lemak,
polisakarida, dan golongan senyawa dipeptida. Komponen penyusun antibiotik dari alga diketahui terdiri dari asam lemak, asam organik, bromofenol, penghambat fenolat, tannin,terpenoid, polisakarida, alkohol. (Metting dan Pyne 1986 diacu dalam Setyaningsih et al. 2000). Produk antibakteri alami sering juga berasal langsung dari senyawaan pembangun metabolit primer seperti golongan senyawa dipeptida. (Quinn 1988 diacu dalam Lailati 2007). Panen Dunaliella sp. dilakukan pada hari ke-7 yang waktunya mendekati fase awal stasioner sehingga selain dihasilkan produk metabolit primer juga mulai dihasilkan produk metabolit sekunder. Selama fase stasioner, senyawa antibakteri diproduksi karena sel bertahan untuk hidup dengan nutrien semakin berkurang dan populasi yang padat. Selain itu, terjadi
akumulasi produk toksik yang merupakan inhibitor. Metabolit sekunder yang diproduksi selama fase stasioner misalnya senyawa terpen, alkaloid, pigmen. (Manitto 1992). Pigmen Dunaliella sp. juga dapat berpotensi sebagai antibakteri. Banyak mikroorganisme berpigmen yang memiliki sifat-sifat antibiotik. (Schlegel dan Schmidt 1994). Produk antibakteri alami umumnya berasal dari hasil senyawaan metabolit sekunder dari berbagai kelompok yaitu senyawa fenol, alkaloid, terpenoid, flavonoid. (Quinn 1988 diacu dalam Lailati 2007). Perbedaan-perbedaan aktivitas antibakteri dapat disebabkan oleh sifat kerentanan dari masing-masing bakteri. Bakteri memiliki kerentanan terhadap sarana fisik dan bahan kimia yang berbeda. Resistensi mikroorganisme terhadap beberapa jenis antibiotik dapat
10
disebabkan oleh sifat yang dimiliki oleh mikroorganisme itu sendiri. (Pelczar dan Chan 2005). Beberapa hal yang dapat menyebabkan mikroorganisme dapat rentan terhadap
antibiotik adalah struktur sel yang kurang lengkap, dinding sel yang impermeabel, dan jenis antibiotik. (Brock dan Madigan 2003). Zona hambat yang dihasilkan oleh ekstrak heksana dan etil asetat terhadap bakteri Escherichia coli lebih kecil bila dibandingkan dengan zona hambat terhadap bakteri Staphylococcus aureus dan Bacillus cereus. Ketahanan Escherichia coli diduga karena menghasilkan protease serin yang aktivitasnya berkorelasi dengan tingkat infeksi yang ditimbulkan. (Budiarti dan Suhartono 1999). Selain itu, bakteri Escherichia coli juga
termasuk bakteri Gram negatif yang memiliki susunan dinding sel lebih kompleks (berlapis tiga) dibandingkan dengan dinding bakteri Gram positif yang berlapis satu. Menurut
Nikaido dan Vaara (1985) diacu dalam Parhusip (2006), bakteri Escherichia coli termasuk golongan bakteri enterik dan mempunyai membran luar yang sangat efektif dalam mempertahankan dirinya dibandingkan bakteri Gram negatif lainnya. Membran luar sel Escherichia coli merupakan protein asam yang dibuat bila lingkungannya tidak mendukung pertumbuhan terutama jika bakteri keluar dari saluran pencernaan. Escherichia coli sensitif terhadap antibiotik jenis kloramfenikol, kanamisin, penisilin, dan sulfonamid. (Tortora et al. 1989). Staphylococcus aureus termasuk bakteri Gram positif yang peka terhadap ekstrak non polar karena bakteri ini mempunyai lapisan peptidoglikan yang mengandung asam amino dan bersifat hidrofobik sehingga lebih mudah ditembus senyawa non polar. (Franklin dan Snow 1989 diacu dalam Parhusip 2006). Staphylococcus aureus juga tidak memiliki molekul reseptor spesifik dan susunan matrik sistem dinding selnya relatif terbuka sehingga penetrasi oleh senyawa antibakteri akan lebih mudah. (Russel 1991 diacu dalam Parhusip 2006). Staphylococcus aureus umumnya sensitif terhadap antibiotik -laktam, tetrasiklin, dan kloramfenikol tetapi resisten terhadap polimiksin dan polynes. (Pelczar dan Chan 2005). Ekstrak-heksana dan ekstrak-etil asetat memiliki aktivitas antibakteri terhadap Bacillus cereus. Bakteri ini termasuk bakteri Gram positif yang mampu menghasilkan enzim protease. Ekstrak-heksana dan ekstrak-etil asetat diduga mampu menghambat aktivitas
enzim protease. Senyawa antibakteri dapat merusak sistem metabolisme di dalam sel dengan cara menghambat sintesis protein bakteri dan menghambat kerja enzim intraseluler. (Kim et al. 1995; Rawel et al. 2001 diacu dalam Parhusip 2006). Sistem enzim yang terpengaruh
11
akan mengakibatkan gangguan pada produksi energi penyusun sel dan sintesis komponen sel secara struktural. Bacillus cereus termasuk bakteri yang peka terhadap minyak atsiri (cinnamon, oregano, thyme, karvakrol, perilaldehyde, resorcyclic acid dan dopamine) dan antibiotik streptomisin, penisilin G. (Friedman et al. 2004 diacu dalam Parhusip 2006). Ekstrak-heksana dan ekstrak-etil asetat mempunyai aktivitas yang spesifik terhadap Vibrio harveyi dengan terbentuknya zona hambat yang lebih besar daripada bakteri lainnya. Vibrio harveyi menghasilkan enzim protease, gelatinase, lipase, elastase, dan urease yang berperan dalam proses metabolisme . (Masini et al. 2007). Ekstrak-heksana dan ekstrak-etil asetat diduga dapat menghambat enzim yang dihasilkan Vibrio harveyi sehingga menyebabkan metabolisme bakteri tersebut terganggu. Setiap enzim yang terdapat di dalam sel merupakan sasaran potensial bagi bekerjanya suatu senyawa antibakteri yang akan
bersaing dengan substrat sehingga enzim tidak aktif. Penghambatan ini dapat mengakibatkan terganggunya metabolisme atau matinya sel. (Pelczar dan Chan 2005). Vibrio harveyi
sensitif terhadap antibiotik rifampisin, kloramfenikol, oksitetrasilin, dan hampir semua antibiotik. (Greenwood et al. 1995). Kloramfenikol sebagai kontrol positif menghasilkan diameter zona hambat lebih besar daripada diameter zona hambat masing-masing ekstrak dengan konsentrasi yang sama. Hal ini disebabkan kloramfenikol merupakan zat antibakteri murni sedangkan ekstrak
Dunaliella sp. masih berupa ekstrak kasar (crude extract) yang mengandung bahan organik lain selain antibakteri. Senyawa organik lain dapat menurunkan aktivitas zat antibakteri dengan cara menginaktivasi dan mengganggu kontak antara zat antibakteri dengan sel bakteri sehingga dapat melindungi bakteri dari zat antibakteri tersebut. (Pelczar dan Chan 2005). Kloramfenikol bekerja dengan cara menghambat sintesa protein sel bakteri yang berlangsung di ribosom. (Setiabudy dan Ganiswara 1995). Ekstrak Dunaliella sp. perlu dimurnikan untuk mendapatkan aktivitas antibakteri yang lebih baik.
12
BAB III PENUTUP
3.1. Kesimpulan Pada penelitian ini, pola pertumbuhan Dunaliella sp. dimulai dari fase log (hari ke-0 sampai ke-8), fase penurunan laju pertumbuhan (hari ke-9 sampai ke-11), fase stasioner (hari ke-12 sampai ke-29), serta fase menuju kematian (hari ke-30 sampai ke-34). Berdasarkan uji proksimat, kandungan air, protein, lemak, abu, dan karbohidrat dari Dunaliella sp. adalah 65,22 %, 18,12 %, 1,60 %, 6,17 %, dan 8,89 %. Berat biomassa kering yang dihasilkan pada umur panen fase stasioner (1,54 gram) lebih besar dibandingkan pada fase log (1,10 gram). Rendemen ekstrak kering pada fase log yang diperoleh dari ekstraksi dengan pelarut heksana, pelarut etil asetat, dan pelarut metanol berturut-turut sebesar 1,81 %, 4,54 %, dan 5,45 %. Rendemen ekstrak kering pada fase stasioner yang dihasilkan dari ekstraksi dengan pelarut heksana, pelarut etil asetat, dan pelarut metanol berturut-turut nilainya adalah 1,29 %, 1,94 %, dan 2,59 %. Ekstrak-metanol dan ekstraseluler tidak menunjukkan adanya aktivitas antibakteri. Hasil uji aktivitas antibakteri ekstrak-heksana dan ekstrak-etil asetat pada fase log terhadap bakteri uji Staphylococcus aureus, Bacillus cereus, Escherichia coli, dan Vibrio harveyi menghasilkan diameter zona bening di sekitar paper disc berturut-turut sebesar 3, 4, 3, 5 mm, serta 2, 2, 2, 3 mm. Hasil uji aktivitas antibakteri ekstrak-heksana dan ekstrak-etil asetat pada fase stasioner terhadap bakteri uji yang sama berturut-turut nilainya adalah 2, 2, 1, 4 mm, serta 2, 3, 2, 4 mm. Ekstrak-heksana dan etil asetat dari Dunaliella sp. yang dipanen pada umur 7 hari (fase log) dan umur 14 hari (fase stasioner) menunjukkan adanya aktivitas antibakteri walaupun kemampuannya tergolong lemah. Pengujian KLT menunjukkan bahwa jumlah komponen aktif yang terdapat pada ekstrak-heksana, ekstrak-etil asetat sebanyak 4 dan 3 komponen.
13
DAFTAR PUSTAKA Becker EW. 1994. Microalgae Biotechnology and Microbiology. USA: Cambridge
University Press. Brock TD, Madigan MT. 2003. Biology of Microoganisms. Sixth edition. Mexico: Prentice Hall International. Budiarti S, Suhartono MT. 1999. Peranan protease pada bakteri patogen. Makalah dipresentasikan pada Pertemuan Ilmiah Tahunan Perhimpunan Mikrobiologi Indonesia. Padang, 3-4 Agustus 1999. Chang T, Ohta S, Ikegami N, Miyata H, Kashimoto T, Kondo M. 1993. Antibiotic
substances produced by a marine green alga, Dunaliella primolecta. Bioresource Technology. 44: 149-153. Dahuri R. 2003. Keanekaragaman Hayati Laut. Aset Pembangunan Berkelanjutan
Indonesia. Jakarta: PT Gramedia Pustaka Utama.
Darusman LK Sajuthi D, Komar, Pamungkas. 1995. Naskah seminar: Ekstraksi komponen bioaktif sebagai obat dari kerang-kerangan, bunga karang dan ganggang laut di perairan pulau Pari kepulauan Seribu. Buletin Kimia. Bogor: Fakultas
Matematika dan Ilmu Pengetahuan Alam.IPB. Davis WW, Stout TR. 1971. Disc plate method of microbiological antibiotic assay. Journal of Microbiology. 22(4): 659-665. Greenwood D, Slack RCB, Peutherer JF, editor. 1995. Hongkong: ELBS. Hadioetomo RS. 1993. Mikrobiologi Dasar dalam Praktek Teknik dan Prosedur Dasar Laboratorium. Jakarta: UI Press Harborne JB. 1987. Metode Kimia. Kosasih P, Iwang S, penerjemah. Bandung: ITB. Terjemahan dari: Phytochemical Methods. Medical Microbiology. Ed ke-14.
14
Herbert RB. 1995.
Biosintesis Metabolit Sekunder. Bambang Srigandono, penerjemah. Semarang: IKIP Semarang Press. Terjemahan dari: The
Edisi kedua.
Biosynthesis of Secondary Metabolites. Houghton PJ, Raman A. 1998. Laboratory Handbook for the Fractionation of Natural
Extracts. London: Chapman and Hall. Indhira TA. 2004. Prospek Bioteknologi Sumberdaya Akuatik dalam Industri Farmasi. Jurnal Perikanan Fakultas Teknologi Kelautan dan Perikanan Univ Hang Tuah Surabaya. 1(1): 27-30. Isnansetyo A, Kurniastuty. 1995. Teknik Kultur Phytoplankton dan Zooplankton. Pakan Alami untuk Pembenihan Organisme Laut. Yogyakarta: Kanisius Kabara JJ. 1993. Medium-chain fatty acids and esters. Di dalam: Branen AL, Davidson PM. Antimicrobial in Foods. Second edition. New York: Marcel Dekker, Inc Kabinawa INK. 1994. Kultur Mikroalga: Aspek dan Prospek. Prosiding Seminar
Nasional Bioteknologi Mikroalga. Bogor: Puslitbang-Biotek.LIPI. ___________. 2001. Mikroalga Sebagai Sumber Daya Hayati Perairan Dalam Perspektif Bioteknologi. Bogor: Puslitbang-Biotek. LIPI. Karger BL, Synder L, Hosvarth C. 1973. An Introduction to Separation. Brisbane: John dan Sons. Lailati N. 2007. Metode ekstraksi dan uji aktivitas antibakteri dari ekstrak Chaetoceros gracilis [skripsi]. Bogor: Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Manitto P. 1992. Biosintesis Produk Alami. Koensoemardiyah, penerjemah. Semarang:
IKIP Press. Terjemahan dari: Biosynthesis of Natural Products. Masini et al. 2007. Research and characterization of pathogenic vibrios from bathing water along the conera Riviera (Central Italy). Water Research. 10:1016. Nontji A. 1993. Laut Nusantara. Edisi ke-2. Jakarta: Djambatan.
15
Parhusip AJN.
2006.
Kajian mekanisme antibakteri ekstrak andaliman (Zanthoxylum Bogor:
acanthopodium DC) terhadap bakteri patogen pangan. [disertasi]. Program Pasca Sarjana, Institut Pertanian Bogor. Pelczar MJ, Reid RD. 1979. Microbiology. Tokyo: Kogusha Co. Ltd.
Pelczar MJ, Chan ECS. 2005. Dasar-dasar Mikrobiologi. Volume ke-1,2. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah. Jakarta: Universitas Indonesia Press. Terjemahan dari: Elemen of Microbiology. Probert I, Klaas C. 1999. Microalga culturing.http://www.nhm.ac.uk/hosted
sites/ina/CoDENET/documents/culture.rtf (1 Desember 2007). Robinson. 1995. Phyto-chemistry in plants. Di dalam: Naidu AS. Natural Food Mycrobial System. USA: CRC Press. Salisbury FB, Ross CW. 1995. Fisiologi Tumbuhan. Lukman DR, Sumaryono, penerjemah. Bandung: ITB. Terjemahan dari: Plant Physiology. Schlegel, Schmidt. 1994. Mikrobiologi Umum. Tedja Baskara, penerjemah. Yogyakarta:
Gajahmada University Press. Setiabudy R, Ganiswara VHS. 1995. Pengantar antimikroba. Di dalam: Ganiswara SG, Setiabudy R, Suyatna FD, Purwantyastuti, Nafrialdi. Farmakologi dan Terapi. Edisi ke-4. Jakarta: FKUI Setyaningsih I, Suptijah P, Ibrahim B, Suwandi R. 2000. Extraction of bioactive compound from Chlorella sp. and its application on fresh fish. Di dalam: Proceeding of International Symposium on Marine Biotechnology (ISMB). Jakarta: Indonesia, 29-31 May 2000 Shahidi F, Naczk M. 1995. Food Phenolic. Lancester: Technomic Publishing Co.Inc Stewart WDP. 1974. Publ. Sudarmadji S, Haryono B, Suhardi. 1989. Yogyakarta: Liberty Analisa Bahan Makanan dan Pertanian. Algal Physiology and Biochemistry. London: Blackwell Scientific
16
Vonshak A. 1990. Recent Advances in Microalgal Biotechnology. Biotechnology adv. Vol 8. Britain: Pergamon Press Winarno FG, Fardiaz D, Fardiaz S. 1973. Ekstraksi, Kromatografi dan Elektroforesis.
Bogor : Fakultas Pertanian, Institut Pertanian Bogor. Winarno FG. 1997. Kimia Pangan dan Gizi. Jakarta: PT Gramedia Pustaka Utama.
17
You might also like
- Laporan Praktikum Biologi Perilaku - Uji Memori MencitDocument15 pagesLaporan Praktikum Biologi Perilaku - Uji Memori MencitRifki Muhammad Iqbal100% (3)
- Laporan Praktikum Reproduksi Dan Perkembangan Hewan - Fertilisasi MencitDocument18 pagesLaporan Praktikum Reproduksi Dan Perkembangan Hewan - Fertilisasi MencitRifki Muhammad Iqbal100% (2)
- Laporan Praktikum Biologi Perilaku-Sensorik Dan MotorikDocument16 pagesLaporan Praktikum Biologi Perilaku-Sensorik Dan MotorikRifki Muhammad Iqbal100% (2)
- Laporan RPH Mencit SD Hari Ke-0 Sampa Ke-8Document3 pagesLaporan RPH Mencit SD Hari Ke-0 Sampa Ke-8Rifki Muhammad IqbalNo ratings yet
- Laporan Sementara Praktikum Hari Ke-8 Sampai Ke-15Document3 pagesLaporan Sementara Praktikum Hari Ke-8 Sampai Ke-15Rifki Muhammad IqbalNo ratings yet
- Laporan RPH Embrio Ayam 15,17,19,21Document1 pageLaporan RPH Embrio Ayam 15,17,19,21Rifki Muhammad IqbalNo ratings yet
- Laporan Sementara Praktikum Hari Ke-15 Sampai Ke-21Document3 pagesLaporan Sementara Praktikum Hari Ke-15 Sampai Ke-21Rifki Muhammad IqbalNo ratings yet
- Laporan RPH Embrio Ayam 3,5, Dan 7Document1 pageLaporan RPH Embrio Ayam 3,5, Dan 7Rifki Muhammad IqbalNo ratings yet
- Laporan Fisiologi Tumbuhan Potensial OsmosisDocument2 pagesLaporan Fisiologi Tumbuhan Potensial OsmosisRifki Muhammad IqbalNo ratings yet
- Laporan Praktikum Reproduksi Dan Perkembangan Hewan-Embrio AyamDocument10 pagesLaporan Praktikum Reproduksi Dan Perkembangan Hewan-Embrio AyamRifki Muhammad IqbalNo ratings yet
- LAPORAN PRAKTIKUM RPH Apusan Vagina Dan Sistem ReproduksiDocument14 pagesLAPORAN PRAKTIKUM RPH Apusan Vagina Dan Sistem ReproduksiRifki Muhammad Iqbal100% (3)
- Laporan Fisiologi Tumbuhan PlasmolisisDocument2 pagesLaporan Fisiologi Tumbuhan PlasmolisisRifki Muhammad Iqbal100% (1)
- Laporan RPH Embrio Ayam 9,11, Dan 13Document1 pageLaporan RPH Embrio Ayam 9,11, Dan 13Rifki Muhammad IqbalNo ratings yet
- Laporan Fisiologi Tumbuhan RespirasiDocument4 pagesLaporan Fisiologi Tumbuhan RespirasiRifki Muhammad IqbalNo ratings yet
- Laporan Fisiologi Tumbuhan Pengukuran Kadar KlorofilDocument4 pagesLaporan Fisiologi Tumbuhan Pengukuran Kadar KlorofilRifki Muhammad IqbalNo ratings yet
- Laporan Fisiologi Tumbuhan Difusi OsmosisDocument4 pagesLaporan Fisiologi Tumbuhan Difusi OsmosisRifki Muhammad IqbalNo ratings yet
- Laporan Fisiologi Tumbuhan Kurva TumbuhDocument6 pagesLaporan Fisiologi Tumbuhan Kurva TumbuhRifki Muhammad Iqbal100% (1)
- Laporan Fisiologi Tumbuhan Jumlah Stomata Terhadap Kecepatan TranspirasiDocument5 pagesLaporan Fisiologi Tumbuhan Jumlah Stomata Terhadap Kecepatan TranspirasiRifki Muhammad IqbalNo ratings yet
- Laporan Praktikum Ekologi Hewan-UnpadDocument17 pagesLaporan Praktikum Ekologi Hewan-UnpadRifki Muhammad IqbalNo ratings yet
- Laporan Fisiologi Tumbuhan Pengaruh Luas Daun Terhadap Absorbsi AirDocument2 pagesLaporan Fisiologi Tumbuhan Pengaruh Luas Daun Terhadap Absorbsi AirRifki Muhammad Iqbal100% (1)
- Laporan Praktikum Biologi Perilaku - Preferensi Suhu Ikan GuppyDocument9 pagesLaporan Praktikum Biologi Perilaku - Preferensi Suhu Ikan GuppyRifki Muhammad Iqbal100% (2)
- Laporan Praktikum Biologi Perilaku-Agonistik CupangDocument18 pagesLaporan Praktikum Biologi Perilaku-Agonistik CupangRifki Muhammad IqbalNo ratings yet
- Laporan Praktikum Fisiologi Hewan-HematologiDocument11 pagesLaporan Praktikum Fisiologi Hewan-HematologiRifki Muhammad Iqbal100% (1)
- Laporan Praktikum Cryptogame-Klorofil JadiDocument13 pagesLaporan Praktikum Cryptogame-Klorofil JadiRifki Muhammad IqbalNo ratings yet
- Laporan Praktikum Genetika-MediaDocument6 pagesLaporan Praktikum Genetika-MediaRifki Muhammad IqbalNo ratings yet
- LAPORAN PRAKTIKUM GENETIKA-Determinasi Dan Siklus HidupDocument7 pagesLAPORAN PRAKTIKUM GENETIKA-Determinasi Dan Siklus HidupRifki Muhammad IqbalNo ratings yet
- LAPORAN PRAKTIKUM GENETIKA-Determinasi Dan Siklus HidupDocument7 pagesLAPORAN PRAKTIKUM GENETIKA-Determinasi Dan Siklus HidupRifki Muhammad IqbalNo ratings yet
- Makalah GenetikaDocument17 pagesMakalah GenetikaRifki Muhammad Iqbal100% (1)
- Laporan Praktikum Genetika 2-TumbDocument8 pagesLaporan Praktikum Genetika 2-TumbRifki Muhammad IqbalNo ratings yet
- Laporan Pratikum Ekologi Hewan-GerejaDocument9 pagesLaporan Pratikum Ekologi Hewan-GerejaRifki Muhammad IqbalNo ratings yet