Professional Documents
Culture Documents
Msds Asam Asetat Glasial
Uploaded by
Galaxy Abdul MalikCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Msds Asam Asetat Glasial
Uploaded by
Galaxy Abdul MalikCopyright:
Available Formats
MSDS Asam Asetat Glasial
Asam asetat, asam etanoat atau asam cuka[2] adalah senyawa kimia asam organik yang dikenal sebagai pemberi rasa asam dan aroma dalam makanan. Asam cuka memiliki rumus empiris C2H4O2. Rumus ini seringkali ditulis dalam bentuk CH3-COOH, CH3COOH, atau CH3CO2H. Asam asetat murni (disebut asam asetat glasial) adalah cairan ...higroskopis tak berwarna, dan memiliki titik beku 16.7C. Asam asetat merupakan salah satu asam karboksilat paling sederhana, setelah asam format. Larutan asam asetat dalam air merupakan sebuah asam lemah, artinya hanya terdisosiasi sebagian menjadi ion H+ dan CH3COO-. Asam asetat merupakan pereaksi kimia dan bahan baku industri yang penting. Asam asetat digunakan dalam produksi polimer seperti polietilena tereftalat, selulosa asetat, dan polivinil asetat, maupun berbagai macam serat dan kain. Dalam industri makanan, asam asetat digunakan sebagai pengatur keasaman. Di rumah tangga, asam asetat encer juga sering digunakan sebagai pelunak air. Dalam setahun, kebutuhan dunia akan asam asetat mencapai 6,5 juta ton per tahun. 1.5 juta ton per tahun diperoleh dari hasil daur ulang, sisanya diperoleh dari industri petrokimia maupun dari sumber hayati. Daftar isi [sembunyikan] 1 Penamaan 2 Sejarah 3 Sifat-sifat kimia 4 Biokimia 4.1 Biosintesis asam asetat 5 Produksi 5.1 Karbonilasi metanol 5.2 Oksidasi asetaldehida 6 Penggunaan 7 Keamanan 8 Lihat pula 9 Referensi 10 Pranala luar [sunting] Penamaan Asam asetat merupakan nama trivial atau nama dagang dari senyawa ini, dan merupakan nama yang paling dianjurkan oleh IUPAC. Nama ini berasal dari kata Latin acetum, yang berarti cuka. Nama sistematis dari senyawa ini adalah asam etanoat. Asam asetat glasial merupakan nama trivial yang merujuk pada asam asetat yang tidak bercampur air. Disebut demikian karena asam asetat bebas-air membentuk kristal mirip es pada 16.7 C, sedikit di bawah suhu ruang. Singkatan yang paling sering digunakan, dan merupakat singkatan resmi bagi asam asetat adalah AcOH atau HOAc dimana Ac berarti gugus asetil, CH3C(=O). Pada konteks asam-basa, asam asetat juga sering disingkat HAc, meskipun banyak yang menganggap singkatan ini tidak benar. Ac juga tidak boleh disalahartikan dengan lambang unsur Aktinium (Ac). [sunting] Sejarah
Kristal asam asetat yang dibekukan Cuka telah dikenal manusia sejak dahulu kala. Cuka dihasilkan oleh berbagai bakteria penghasil asam asetat, dan asam asetat merupakan hasil samping dari pembuatan bir atau anggur. Penggunaan asam asetat sebagai pereaksi kimia juga sudah dimulai sejak lama. Pada abat ke-3 Sebelum Masehi, Filsuf Yunani kuno Theophrastos menjelaskan bahwa cuka bereaksi dengan logam-logam membentuk berbagai zat warna, misalnya timbal putih (timbal karbonat), dan verdigris, yaitu suatu zat hijau campuran dari garam-garam tembaga dan mengandung tembaga (II) asetat. Bangsa Romawi menghasilkan sapa, sebuah sirup yang amat manis, dengan mendidihkan anggur yang sudah asam. Sapa mengandung timbal asetat, suatu zat manis yang disebut juga gula timbal dan gula Saturnus. Akhirnya hal ini berlanjut kepada peracunan dengan timbal yang dilakukan oleh para pejabat Romawi. Pada abad ke-8, ilmuwan Persia Jabir ibn Hayyan menghasilkan asam asetat pekat dari cuka melalui distilasi. Pada masa renaisans, asam asetat glasial dihasilkan dari distilasi kering logam asetat. Pada abad ke-16 ahli alkimia Jerman Andreas Libavius menjelaskan prosedur tersebut, dan membandingkan asam asetat glasial yang dihasilkan terhadap cuka. Ternyata asam asetat glasial memiliki banyak perbedaan sifat dengan larutan asam asetat dalam air, sehingga banyak ahli kimia yang mempercayai bahwa keduanya sebenarnya adalah dua zat yang berbeda. Ahli kimia Prancis Pierre Adet akhirnya membuktikan bahwa kedua zat ini sebenarnya sama. Pada 1847 kimiawan Jerman Hermann Kolbe mensintesis asam asetat dari zat anorganik untuk pertama kalinya. Reaksi kimia yang dilakukan adalah klorinasi karbon disulfida menjadi karbon tetraklorida, diikuti dengan pirolisis menjadi tetrakloroetilena dan klorinasi dalam air menjadi asam trikloroasetat, dan akhirnya reduksi melalui elektrolisis menjadi asam asetat. Sejak 1910 kebanyakan asam asetat dihasilkan dari cairan piroligneous yang diperoleh dari distilasi kayu. Cairan ini direaksikan dengan kalsium hidroksida menghasilkan kalsium asetat yang kemudian diasamkan dengan asam sulfat menghasilkan asam asetat. [sunting] Sifat-sifat kimia Keasaman
Atom hidrogen (H) pada gugus karboksil (COOH) dalam asam karboksilat seperti asam asetat dapat dilepaskan sebagai ion H+ (proton), sehingga memberikan sifat asam. Asam asetat adalah asam lemah monoprotik dengan nilai pKa=4.8. Basa konjugasinya adalah asetat (CH3COO). Sebuah larutan 1.0 M asam asetat (kira-kira sama dengan konsentrasi pada cuka rumah) memiliki pH sekitar 2.4. Dimer siklis
Dimer siklis dari asam asetat, garis putus-putus melambangkan ikatan hidrogen. Struktur kristal asam asetat menunjukkan bahwa molekul-molekul asam asetat berpasangan membentuk dimer yang dihubungkan oleh ikatan hidrogen.[3] Dimer juga dapat dideteksi pada uap bersuhu 120 C. Dimer juga terjadi pada larutan encer di dalam pelarut tak-berikatan-hidrogen, dan kadang-kadang pada cairan asam asetat murni.[4] Dimer dirusak dengan adanya pelarut berikatan hidrogen (misalnya air). Entalpi disosiasi dimer tersebut diperkirakan 65.066.0 kJ/mol, entropi disosiasi sekitar 154157 J mol1 K1.[5] Sifat dimerisasi ini juga dimiliki oleh asam karboksilat sederhana lainnya. Sebagai Pelarut Asam asetat cair adalah pelarut protik hidrofilik (polar), mirip seperti air dan etanol. Asam asetat memiliki konstanta dielektrik yang sedang yaitu 6.2, sehingga ia bisa melarutkan baik senyawa polar seperi garam anorganik dan gula maupun senyawa non-polar seperti minyak dan unsur-unsur seperti sulfur dan iodin. Asam asetat bercambur dengan mudah dengan pelarut polar atau nonpolar lainnya seperti air, kloroform dan heksana. Sifat kelarutan dan kemudahan bercampur dari asam asetat ini membuatnya digunakan secara luas dalam industri kimia. Reaksi-reaksi kimia Asam asetat bersifat korosif terhadap banyak logam seperti besi, magnesium, dan seng, membentuk gas hidrogen dan garam-garam asetat (disebut logam asetat). Logam asetat juga dapat diperoleh dengan reaksi asam asetat dengan suatu basa yang cocok. Contoh yang terkenal adalah reaksi soda kue (Natrium bikarbonat) bereaksi dengan cuka. Hapir semua garam asetat larut dengan baik dalam air. Salah satu pengecualian adalah kromium (II) asetat. Contoh reaksi pembentukan garam asetat: Mg(s) + 2 CH3COOH(aq) (CH3COO)2Mg(aq) + H2(g) NaHCO3(s) + CH3COOH(aq) CH3COONa(aq) + CO2(g) + H2O(l) Aluminium merupakan logam yang tahan terhadap korosi karena dapat membentuk lapisan aluminium oksida yang melindungi permukaannya. Karena itu, biasanya asam asetat diangkut dengan tangki-tangki aluminium.
Dua reaksi organik tipikal dari asam asetat Asam asetat mengalami reaksi-reaksi asam karboksilat, misalnya menghasilkan garam asetat bila bereaksi dengan alkali, menghasilkan logam etanoat bila bereaksi dengan logam, dan menghasilkan logam etanoat, air dan karbondioksida bila bereaksi dengan garam karbonat atau bikarbonat. Reaksi organik yang paling terkenal dari asam asetat adalah pembentukan etanol melalui reduksi, pembentukan turunan asam karboksilat seperti asetil klorida atau anhidrida asetat melalui substitusi nukleofilik. Anhidrida asetat dibentuk melalui kondensasi dua molekul asam asetat. Ester dari asam asetat dapat diperoleh melalui reaksi esterifikasi Fischer, dan juga pembentukan amida. Pada suhu 440 C, asam asetat terurai menjadi metana dan karbon dioksida, atau ketena dan air. Deteksi Asam asetat dapat dikenali dengan baunya yang khas. Selain itu, garam-garam dari asam asetat bereaksi dengan larutan besi(III) klorida, yang menghasilkan warna merah pekat yang hilang bila larutan diasamkan. Garam-garam asetat bila dipanaskan dengan arsenik trioksida (AsO3) membentuk kakodil oksida ((CH3)2As-OAs(CH3)2), yang mudah dikenali dengan baunya yang tidak menyenangkan. [sunting] Biokimia Gugus asetil yang terdapat pada asam asetat merupakan gugus yang penting bagi biokimia pada hampir seluruh makhluk hidup, seperti gugus asetil yang berikat pada koenzim A menjadi senyawa yang disebut AsetilKoA, merupakan enzim utama bagi metabolisme karbohidrat dan lemak. Namun demikian, asam asetat bebas memiliki konsentrasi yang kecil dalam sel, karena asam asetat bebas dapat menyebabkan gangguan pada mekanisme pengaturan pH sel. Berbeda dengan asam karboksilat berantai panjang, asam asetat tidak ditemukan pada trigliserida dalam tubuh makhluk hidup. Sekalipun demikian, trigliserida buatan yang memiliki gugus asetat, triasetin (trigliserin asetat), adalah zat aditif yang umum pada makanan, dan juga digunakan dalam kosmetika dan obat-obatan.
Asam asetat diproduksi dan diekskresikan oleh bakteri-bakteri tertentu, misalnya dari genus Acetobacter dan spesies Clostridium acetobutylicum. Bakteri-bakteri ini terdapat pada makanan, air, dan juga tanah, sehingga asam asetat secara alami diproduksi pada buah-buahan/makanan yang telah basi. Asam asetat juga terdapat pelumas vagina manusia dan primata lainnya, berperan sebagai agen anti-bakteri.[6] [sunting] Biosintesis asam asetat Asam asetat merupakan produk katabolisme aerob dalam jalur glikolisis atau perombakan glukosa. Asam piruvat sebagai produk oksidasi glukosa dioksidasi oleh NAD+ terion lalu segera diikat oleh Koenzim-A. Pada prokariota proses ini terjadi di sitoplasma sementara pada eukariota berlangsung pada mitokondria. [sunting] Produksi
Pabrik pemurnian asam asetat di tahun 1884 Asam asetat diproduksi secara sintetis maupun secara alami melalui fermentasi bakteri. Sekarang hanya 10% dari produksi asam asetat dihasilkan melalui jalur alami, namun kebanyakan hukum yang mengatur bahwa asam asetat yang terdapat dalam cuka haruslah berasal dari proses biologis. Dari asam asetat yang diproduksi oleh industri kimia, 75% diantaranya diproduksi melalui karbonilasi metanol. Sisanya dihasilkan melalui metode-metode alternatif.[7] Produksi total asam asetat dunia diperkirakan 5 Mt/a (juta ton per tahun), setengahnya diproduksi di Amerika Serikat. Eropa memproduksi sekitar 1 Mt/a dan terus menurun, sedangkan Jepang memproduksi sekitar 0.7 Mt/a. 1.51 Mt/a dihasilkan melalui daur ulang, sehingga total pasar asam asetat mencapai 6.51 Mt/a.[8][9] Perusahan produser asam asetat terbesar adalah Celanese dan BP Chemicals. Produsen lainnya adalah Millenium Chemicals, Sterling Chemicals, Samsung, Eastman, dan Svensk Etanolkemi. [sunting] Karbonilasi metanol Kebanyakan asam asetat murni dihasilkan melalui karbonilasi. Dalam reaksi ini, metanol dan karbon monoksida bereaksi menghasilkan asam asetat CH3OH + CO CH3COOH Proses ini melibatkan iodometana sebagai zat antara, dimana reaksi itu sendiri terjadi dalam tiga tahap dengan katalis logam kompleks pada tahap kedua. (1) CH3OH + HI CH3I + H2O (2) CH3I + CO CH3COI (3) CH3COI + H2O CH3COOH + HI Jika kondisi reaksi diatas diatur sedemikian rupa, proses tersebut juga dapat menghasilkan anhidrida asetat sebagai hasil tambahan. Karbonilasi metanol sejak lama merupakan metode paling menjanjikan dalam produksi asam asetat karena baik metanol maupun karbon monoksida merupakan bahan mentah komoditi. Henry Dreyfus mengembangkan cikal bakal pabrik karbonilasi metanol pada perusahaan Celanese di tahun 1925.[10] Namun, kurangnya bahan-bahan praktis yang dapat diisi bahan-bahan korosif dari reaksi ini pada tekanan yang dibutuhkan yaitu 200 atm menyebabkan metoda ini ditinggalkan untuk tujuan komersial. Baru pada 1963 pabrik komersial pertama yang menggunakan karbonilasi metanol didirikan oleh perusahaan kimia Jerman, BASF dengan katalis kobalt (Co). Pada 1968, ditemukan katalis kompleks Rhodium, cis[Rh(CO)2I2] yang dapat beroperasi dengan optimal pada tekanan rendah tanpa produk sampingan. Pabrik pertama yang menggunakan katalis tersebut adalah perusahan kimia AS Monsanto pada 1970, dan metode karbonilasi metanol berkatalis Rhodium dinamakan proses Monsanto dan menjadi metode produksi asam asetat paling dominan. Pada akhir 1990'an, perusahan petrokimia British Petroleum mengkomersialisasi katalis Cativa ([Ir(CO)2I2]) yang didukung oleh ruthenium. Proses berbasis iridium ini lebih efisien dan lebih "hijau" dari metode sebelumnya[11], sehingga menggantikan proses Monsanto. [sunting] Oksidasi asetaldehida Sebelum komersialisasi proses Monsanto, kebanyakan asam asetat diproduksi melalui oksidasi asetaldehida. Sekarang oksidasi asetaldehida merupakan metoda produksi asam asetat kedua terpenting, sekalipun tidak kompetitif bila dibandingkan dengan metode karbonilasi metanol. Asetaldehida yang digunakan dihasilkan melalui oksidasi butana atau nafta ringan, atau hidrasi dari etilena. Saat butena atau nafta ringan dipanaskan bersama udara disertai dengan beberapa ion logam, termasuk ion mangan, kobalt dan kromium, terbentuk peroksida yang selanjutnya terurai menjadi asam asetat sesuai dengan persamaan reaksi dibawah ini. 2 C4H10 + 5 O2 4 CH3COOH + 2 H2O Umumnya reaksi ini dijalankan pada temperatur dan tekanan sedemikian rupa sehingga tercapai suhu setinggi mungkin namut butana masih berwujud cair. Kondisi reaksi pada umumnya sekitar 150 C and 55 atm. Produk sampingan seperti butanon, etil asetat, asam format dan asam propionat juga mungkin terbentuk. Produk sampingan ini juga bernilai komersial dan jika diinginkan kondisi reaksi dapat diubah untuk menghasilkan lebih
banyak produk samping, namun pemisahannya dari asam asetat menjadi kendala karena membutuhkan biaya lebih banyak lagi. Melalui kondisi dan katalis yang sama asetaldehida dapat dioksidasi oleh oksigen udara menghasilkan asam asetat. 2 CH3CHO + O2 2 CH3COOH Dengan menggunakan katalis modern, reaksi ini dapat memiliki rasio hasil (yield) lebih besar dari 95%. Produk samping utamanya adalah etil asetat, asam format dan formaldehida, semuanya memiliki titik didih yang lebih rendah daripada asam asetat sehingga dapat dipisahkan dengan mudah melalui distilasi. [sunting] Penggunaan
Botol berisi 2,5 liter asam asetat di laboratorium Asam asetat digunakan sebagai pereaksi kimia untuk menghasilkan berbagai senyawa kimia. Sebagian besar (40-45%) dari asam asetat dunia digunakan sebagai bahan untuk memproduksi monomer vinil asetat (vinyl acetate monomer, VAM). Selain itu asam asetat juga digunakan dalam produksi anhidrida asetat dan juga ester. Penggunaan asam asetat lainnya, termasuk penggunaan dalam cuka relatif kecil. [sunting] Keamanan Asam asetat pekat bersifat korosif dan karena itu harus digunakan dengan penuh hati-hati. Asam asetat dapat menyebabkan luka bakar, kerusakan mata permanen, serta iritasi pada membran mukosa. Luka bakar atau lepuhan bisa jadi tidak terlihat hingga beberapa jam setelah kontak. Sarung tangan latex tidak melindungi dari asam asetat, sehingga dalam menangani senyawa ini perlu digunakan sarung tangan berbahan karet nitril. Asam asetat pekat juga dapat terbakar di laboratorium, namun dengan sulit. Ia menjadi mudah terbakar jika suhu ruang melebihi 39 C (102 F), dan dapat membentuk campuran yang mudah meledak di udara (ambang ledakan: 5.4%-16%).
Asam asetat adalah senyawa korosif Konsentrasi berdasar berat Molaritas Klasifikasi Frase-R 10%25% 1.674.16 mol/L Iritan (Xi) R36/38 25%90% 4.1614.99 mol/L Korosif (C) R34 >90% >14.99 mol/L Korosif (C) R10, R35 Larutan asam asetat dengan konsentrasi lebih dari 25% harus ditangani di sungkup asap (fume hood) karena uapnya yang korosif dan berbau. Asam asetat encer, seperti pada cuka, tidak berbahaya. Namun konsumsi asam asetat yang lebih pekat adalah berbahaya bagi manusia maupun hewan. Hal itu dapat menyebabkan kerusakan pada sistem pencernaan, dan perubahan yang mematikan pada keasaman darah.
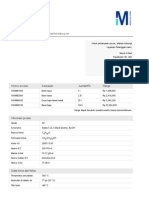
Informasi produk Grade Ph Eur,BP,JP,USP,E 260 Rumus kimia
C2H4O2 Formulasi kimia CH3COOH Kode HS 2915 21 00 Nomor EC 200-580-7 Massa molar 60.05 g/mol Penyimpanan Simpan pada +15C hingga +25C. Nomor indeks EC 607-002-00-6 Nomor CAS 64-19-7 Data kimia dan fisika Temperatur penyalaan 485 C Kelarutan di dalam air (20 C) larut Kosentrasi jenuh (udara) 38 g/m3 (20 C) Udara Titik leleh 17 C Massa molar 60.05 g/mol Densitas 1.05 g/cm3 (20 C) Angka pH 2.5 (50 g/l, H2O, 20 C) Titik didih 116 - 118 C (1013 hPa) Tekanan uap 15.4 hPa (20 C) Batasan ledakan 4 - 19.9 %(V) Titik nyala 44 C Indeks Refraktif 1.37 (20 C) Viskositas kinematis 1.17 mm2/s (20 C) Angka evaporasi 24 Informasi keselamatan berdasarkan GHS Hazard Statement(s) H226: Cairan dan uap yang mudah terbakar H314: Menyebabkan luka bakar pada kulit dan kerusakan mata yang serius. Precautionary Statement(s) P280: Gunakan pakaian/ sarungtangan pelindung / pelindung mata/ muka. P301 + P330 + P331: JIKA TERTELAN: Berkumurlah. JANGAN memancing muntah. P305 + P351 + P338: JIKA TERKENA MATA: Bilas secara hati-hati dengan air selama beberapa menit. Lepas lensa kontak, jika digunakan dan mudah melakukannya. Lanjutkan membilas. Signal Word
Bahaya Hazard Pictogram(s) RTECS AF1225000 Kelas penyimpanan 3 Zat-zat cair yang dapat terbakar WGK WGK 1 agak berbahaya untuk air Informasi keselamatan kerja Frase R R 10-35 Mudah-menyala.Mengakibatkan luka bakar yang parah. Frase S S 23-26-45 Jangan menghirup uap.Jika kena mata, segera bilas dengan banyak air dan dapatkan bantuan medis.Jika terjadi kecelakaan atau jika merasa tidak enak badan, segera dapatkan bantuan medis (tunjukkan label jika mungkin). Jenis-jenis bahaya dapat terbakar, korosif Hazard Symbol Corrosive Informasi Transportasi Pernyataan (jalur kereta api dan jalan raya) ADR, RRID UN 2789 Eisessig, 8 (3), II Pernyataan (transportasi melalui laut) Kode-IMDG UN 2789 ACETIC ACID, GLACIAL, 8 (3), II, Segregation Group: 1 (Acids) Pernyataan (transportasi melalui udara) IATA-DGR UN 2789 ACETIC ACID, GLACIAL, 8 (3), II Data toksikologis LD 50 tertelan LD50 tikus 3310 mg/kg LD 50 melalui kulit LD50 kelinci 1060 mg/kg
You might also like
- PEMBENTUKAN ETIL ASETATDocument23 pagesPEMBENTUKAN ETIL ASETATNaruhikoYoshimura100% (1)
- Asam AsetatDocument12 pagesAsam AsetatSarah WoodNo ratings yet
- MSDS Kalium IodidaDocument14 pagesMSDS Kalium Iodidarizki aldhiNo ratings yet
- Limun Sebagai Minuman BerkarbonasiDocument8 pagesLimun Sebagai Minuman BerkarbonasisilfianandaNo ratings yet
- IodiumDocument12 pagesIodiumsyifa anandaNo ratings yet
- Msds Etil AsetatDocument3 pagesMsds Etil Asetatasri94_purple9781No ratings yet
- Kalium HidroksidaDocument12 pagesKalium HidroksidaMaulana Fuerra FirdausNo ratings yet
- Msds AnionDocument3 pagesMsds AnionlestariNo ratings yet
- MSDS Etil AsetatDocument3 pagesMSDS Etil AsetatlimaduaNo ratings yet
- Kinetika Reaksi KimiaDocument22 pagesKinetika Reaksi KimiarisylnNo ratings yet
- Jurnal Penetapan Kadar Etanol Dalam Sampel Obat Eliksir Dengan GC-PKT 36-XIII.5-DysprosinaDocument4 pagesJurnal Penetapan Kadar Etanol Dalam Sampel Obat Eliksir Dengan GC-PKT 36-XIII.5-DysprosinaSarahMaulina100% (1)
- Brom MSDSDocument10 pagesBrom MSDSadrik syahirul fahmi0% (1)
- Lampiran Msds Asam Pikrat PDF FreeDocument1 pageLampiran Msds Asam Pikrat PDF FreeFauzan FebriyantoNo ratings yet
- MSDS Asam OksalatDocument2 pagesMSDS Asam Oksalateren_febrio50% (4)
- AlkoholDocument25 pagesAlkoholfarmasiunsriNo ratings yet
- Ethanol (C2h5oh)Document3 pagesEthanol (C2h5oh)Mita NapitasariNo ratings yet
- Material Safety Data Sheets HCLDocument9 pagesMaterial Safety Data Sheets HCLAaron Jrz RamseyNo ratings yet
- PlatinaDocument7 pagesPlatinaRizkiaNurFajriyatiNo ratings yet
- Msds Perc - XiDocument9 pagesMsds Perc - XiFauzi AbdilahNo ratings yet
- BAB III KualitatifDocument12 pagesBAB III KualitatifTika Risyad100% (1)
- Msds Asam OksalatDocument11 pagesMsds Asam OksalatUdien Putra Kuansing0% (1)
- Daftar PustakaDocument1 pageDaftar PustakaIstikhori FitriannisaNo ratings yet
- LAPORANDocument26 pagesLAPORANEunnurr Fitriana HNo ratings yet
- MSDS Piridoksin TerjemahanDocument11 pagesMSDS Piridoksin TerjemahanMila QuinonesNo ratings yet
- Jurnal NitrasiDocument4 pagesJurnal Nitrasianon_842587575No ratings yet
- MSDS Asam LaktatDocument7 pagesMSDS Asam LaktatIstiqomah Asmawati Shafiyah100% (1)
- Titik IsoelektrikDocument7 pagesTitik IsoelektrikendiNo ratings yet
- Asam Sitrat - Wikipedia Bahasa Indonesia, Ensiklopedia BebasDocument4 pagesAsam Sitrat - Wikipedia Bahasa Indonesia, Ensiklopedia BebasVika VeronikaNo ratings yet
- Msds Nitric Acid 69 - 71Document11 pagesMsds Nitric Acid 69 - 71evinNo ratings yet
- OPTIMASI MSDS TEMBAGA(II) SULFATDocument4 pagesOPTIMASI MSDS TEMBAGA(II) SULFATA-FulcaNo ratings yet
- Prinsip PercobaanDocument2 pagesPrinsip PercobaanMohamadJamaludinNo ratings yet
- Laporan KimiaDocument12 pagesLaporan KimiaRiyanNo ratings yet
- MSDS ButanolDocument3 pagesMSDS ButanolRizkita AmandaNo ratings yet
- Sifat Fisik Dan Kimia AlkoholDocument3 pagesSifat Fisik Dan Kimia AlkoholGregah PangayomanNo ratings yet
- Senyawa KumarinDocument3 pagesSenyawa KumarinEko ArdiantoNo ratings yet
- EKSTRAK KAYU SECANGDocument9 pagesEKSTRAK KAYU SECANGKareninaa TantriNo ratings yet
- Msds AlizarinDocument7 pagesMsds AlizarinCefy YulianaNo ratings yet
- Pao AmoxisilinDocument61 pagesPao AmoxisilinPutri AsysyifaNo ratings yet
- Paper Praktikum Kimia Organik-2Document26 pagesPaper Praktikum Kimia Organik-2maudysakinahNo ratings yet
- OPTIMALKAN MSDSDocument7 pagesOPTIMALKAN MSDSRisyad DandiNo ratings yet
- Resume Data Keselamatan Bahan BaCl2Document3 pagesResume Data Keselamatan Bahan BaCl2RofiqohAR SugiartoNo ratings yet
- MSDS KimdasDocument7 pagesMSDS KimdasErni Kusumawati NingsihNo ratings yet
- 32 - Reaksi Khusus Pada Aldehid Dan KetonDocument14 pages32 - Reaksi Khusus Pada Aldehid Dan Ketonlaili ramadhanNo ratings yet
- MSDS Potassium Chromate (Indo)Document10 pagesMSDS Potassium Chromate (Indo)Firdaus MatanariNo ratings yet
- Jurnal Praktikum TitrimetriDocument6 pagesJurnal Praktikum Titrimetriputrik agustinaNo ratings yet
- MSDS AsetonDocument6 pagesMSDS AsetonrifkasyaputriNo ratings yet
- Laporan Praktikum Pembuatan Pereaksi (Fira)Document16 pagesLaporan Praktikum Pembuatan Pereaksi (Fira)firaafrialty100% (2)
- Laporan Praktikum Farmasi Fisik IIDocument19 pagesLaporan Praktikum Farmasi Fisik IIvirda.maulidyaNo ratings yet
- SEJARAH DAN KOMPOSISI SABUNDocument12 pagesSEJARAH DAN KOMPOSISI SABUNAntika WahyusNo ratings yet
- HDocument14 pagesHRahim PainNo ratings yet
- Jurnal Kimia AnalitikDocument13 pagesJurnal Kimia AnalitikAulia Nur AfrilianaNo ratings yet
- Daftar PustakaDocument4 pagesDaftar PustakaAnonymous 0WdQet4No ratings yet
- Material Safety Data Sheet (MSDS) H2SO4Document3 pagesMaterial Safety Data Sheet (MSDS) H2SO4Ganis KesumawardaniNo ratings yet
- OPTIMASI REAKSI ENZIMDocument6 pagesOPTIMASI REAKSI ENZIMIbnu FadilahNo ratings yet
- Asam AsetatDocument27 pagesAsam AsetatAnya Anya WaeNo ratings yet
- Asam AsetatDocument11 pagesAsam AsetatAlfinsyah FridiyandraNo ratings yet
- Asam AsetatDocument19 pagesAsam AsetatHasan MabrurNo ratings yet
- Asam AsetatDocument10 pagesAsam AsetatYustinus PanduNo ratings yet
- ASAM ASETAT SEBAGAI ASAM KARBOKSILAT PENTINGDocument15 pagesASAM ASETAT SEBAGAI ASAM KARBOKSILAT PENTINGdevi abriyaniNo ratings yet
- Reaksi Kimia Dalam AirDocument57 pagesReaksi Kimia Dalam AirBetty PurwatiNo ratings yet
- Bab 2. Identitas NasionalDocument12 pagesBab 2. Identitas NasionalGalaxy Abdul MalikNo ratings yet
- Kalender Akademik 2012 2013Document1 pageKalender Akademik 2012 2013Galaxy Abdul MalikNo ratings yet
- KIMIA ORGANIK DASARDocument21 pagesKIMIA ORGANIK DASARNanang Cuzie PunkRock LowRidersNo ratings yet
- SPO Dodol 1Document13 pagesSPO Dodol 1Galaxy Abdul MalikNo ratings yet
- Dampak Limbah b3 Dan Upaya PengelolaannyaDocument24 pagesDampak Limbah b3 Dan Upaya PengelolaannyaAli AsnanNo ratings yet
- StoikiometriDocument16 pagesStoikiometriGalaxy Abdul Malik100% (1)
- Analisis Kualitatif Kation Dan AnionDocument18 pagesAnalisis Kualitatif Kation Dan AnionEvi SetiatinNo ratings yet
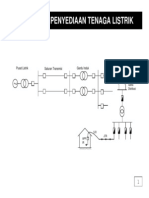
- Konsep Dasar Pembangkitan & Penyaluran Tenaga ListrikDocument42 pagesKonsep Dasar Pembangkitan & Penyaluran Tenaga ListrikGalaxy Abdul MalikNo ratings yet
- RANGKAIAN ARUSDocument10 pagesRANGKAIAN ARUSfiqrih_1No ratings yet