Professional Documents
Culture Documents
Aturan Fasa Gibbs
Uploaded by
Syarif MuhammadCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Aturan Fasa Gibbs
Uploaded by
Syarif MuhammadCopyright:
Available Formats
Aturan Fasa Gibbs
Pendahuluan
Fasa adalah sejumlah zat yang homogen baik secara kimia maupun fisika, atau keadaan materi yang seragam di seluruh bagiannya, bukan hanya dalam komposisi kimianya melainkan juga dalam keadaan fisiknya.
Aturan fasa untuk pertama kali diperkenalkan
oleh J. Willard Gibbs (1876), tetapi baru
dipublikasikan 20 tahun kemudian.
Sifat suatu fasa dinyatakan dengan propertiproperti intensif, dan biasanya properti-properti intensif yang diperhatikan adalah temperatur, tekanan, dan konsentrasi.
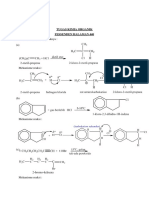
Hukum Fasa Gibbs
Josiah Willard Gibbs menyatakan bahwa untuk
kesetimbangan apapun dalam sistem tertutup, jumlah variabel bebas disebut derajat kebebasan (F) yang sama dengan jumlah komponen (C) ditambah 2 dikurangi jumlah fasa (P), yakni:
F = C+2-P
F= derajat kebebasan C= Jumlah komponen P= Jumlah fasa
Aturan fase Gibbs berlaku untuk semua materi (padat, cair, dan gas). Terdapat dua macam hubungan antara konsentrasi komponen-komponen yaitu kesetimbangan kimia dan keadaan awal. Bagi tiap kesetimbangan kimia jumlah konsentrasi yang bebas berkurang sebuah. Sebagai contoh, bila kalsium oksida padat, kalsium karbonat
padat, dan gas karbon dioksida berada dalam kesetimbangan,
jumlah komponen berkurang dengan satu oleh adanya kesetimbangan kimia. Jumlah derajat kebebasan atau varian v
suatu sistem ialah bilangan terkecil yang menunjukkan jumlah
variable bebas (tekanan, suhu, konsentrasi berbagai fasa) yang harus diberi harga untuk melukiskan keadaan sistem.
You might also like
- Kesetimbangan FasaDocument13 pagesKesetimbangan FasaIren BungaNo ratings yet
- Hukum Fasa GibbsDocument6 pagesHukum Fasa GibbsAnton PrayogaNo ratings yet
- Tugas Mentranslate Dan Membuat Pertanyaan Seputar Energi Bebas GibbsDocument9 pagesTugas Mentranslate Dan Membuat Pertanyaan Seputar Energi Bebas GibbsAsrilNo ratings yet
- Laporan Praktikum Kimia Fisik: Kesetimbangan Fase Dua KomponenDocument13 pagesLaporan Praktikum Kimia Fisik: Kesetimbangan Fase Dua KomponenAmanah Firdausa100% (1)
- Laporan Praktikum Kimia Fisika2...Document6 pagesLaporan Praktikum Kimia Fisika2...Pradila DefriatiNo ratings yet
- Hukum Raoult (Kel 6)Document15 pagesHukum Raoult (Kel 6)Artauli F. O. Sigalingging100% (1)
- Kul1 Kesetimbangan & KespontananDocument69 pagesKul1 Kesetimbangan & KespontananMuna Alfi ANo ratings yet
- Lapres Kesetimbangan Fasa Dua KomponenDocument21 pagesLapres Kesetimbangan Fasa Dua KomponenBagus Setiawan100% (1)
- DIAGRAM TERNER DAN KELARUTANDocument18 pagesDIAGRAM TERNER DAN KELARUTANErsa Nurul YarizsaNo ratings yet
- KA19 19030234044 Muklash Imaduddin Tugas 3Document7 pagesKA19 19030234044 Muklash Imaduddin Tugas 3Mukhlash ImaduddinNo ratings yet
- OPTIMASI ENTROPIDocument33 pagesOPTIMASI ENTROPIAgnes klon Tsu100% (1)
- Astrid Alfira Noermawati - 20030234024 - Tugas Kimfis LKM MOTDocument19 pagesAstrid Alfira Noermawati - 20030234024 - Tugas Kimfis LKM MOTAstrid AlfiraNo ratings yet
- LarutanDocument73 pagesLarutanFemi Juana Putri GintingNo ratings yet
- 4.kelarutan Sebagai Fungsi SuhuDocument19 pages4.kelarutan Sebagai Fungsi SuhuAbdus SyakirNo ratings yet
- Prinsip destilasi dan tujuan pemurnian zat cairDocument4 pagesPrinsip destilasi dan tujuan pemurnian zat cairpsychopassNo ratings yet
- Laporan Praktikum Volume MolalDocument30 pagesLaporan Praktikum Volume MolalMohamadJamaludinNo ratings yet
- ISOMER OKSALATDocument13 pagesISOMER OKSALATAzizah MunitaNo ratings yet
- Brom MSDSDocument10 pagesBrom MSDSadrik syahirul fahmi0% (1)
- Laporan Kimia Fisika 1 Klmpok 1Document19 pagesLaporan Kimia Fisika 1 Klmpok 1Dwi HartatiNo ratings yet
- GAYA ANTARMOLEKULDocument11 pagesGAYA ANTARMOLEKULqory sidwa jufriNo ratings yet
- Laporan Sifat Ikatan, Muatan, Dan Vibrasi Beberapa Struktur Senyawa Organik SederhanaDocument40 pagesLaporan Sifat Ikatan, Muatan, Dan Vibrasi Beberapa Struktur Senyawa Organik SederhanaAninditya S WNo ratings yet
- Kesetimbangan 2 FasaDocument22 pagesKesetimbangan 2 FasaNurina K. Pratiwi100% (3)
- TUGAS KIMIA FISIKA 1 Bab VIIDocument5 pagesTUGAS KIMIA FISIKA 1 Bab VIIRay Riang Hepat100% (1)
- 5.laporan PKO2 - Ahda Bayani Awaliyah - 1917011097Document35 pages5.laporan PKO2 - Ahda Bayani Awaliyah - 1917011097Ahda Bayani Awaliyah0% (1)
- Jurnal Kimia Organik PraktikumDocument90 pagesJurnal Kimia Organik PraktikumJeni TambaNo ratings yet
- Landasan Teori Diagram TernerDocument8 pagesLandasan Teori Diagram TernerFradilla OlsyNo ratings yet
- Kinetika KimiaDocument37 pagesKinetika KimiaDicky FauziNo ratings yet
- Sintesa Asam Sulfanilat SSDocument16 pagesSintesa Asam Sulfanilat SSSalsabilaAzisNo ratings yet
- Percobaan 4Document4 pagesPercobaan 4Anis FuadNo ratings yet
- Koefisien Distribusi Dan Tetapan Kesetimbangan ReaksiDocument23 pagesKoefisien Distribusi Dan Tetapan Kesetimbangan ReaksiBenedict Reagan0% (3)
- Yeni Adi Tiani - 20307141046 - Energi PembakaranDocument15 pagesYeni Adi Tiani - 20307141046 - Energi PembakaranYeni AdtnNo ratings yet
- DIAN Kelarutan Timbal Balik Sistem Biner Fenol-AirDocument8 pagesDIAN Kelarutan Timbal Balik Sistem Biner Fenol-AirDian MustikasariNo ratings yet
- Laporan Praktiku Cis Trans Kalium Dioksalato Diakuo Kromat (III)Document11 pagesLaporan Praktiku Cis Trans Kalium Dioksalato Diakuo Kromat (III)Nadia YulisaNo ratings yet
- Makalah Nomor Atom Efektif - Kelompok 1Document5 pagesMakalah Nomor Atom Efektif - Kelompok 1rohmatus syafi'ahNo ratings yet
- Distribusi Solut Diantara Dua Pelarut Dan Identifikasi Lapisan OrganikDocument8 pagesDistribusi Solut Diantara Dua Pelarut Dan Identifikasi Lapisan OrganikHadi Birnando100% (1)
- Format Laporan Resmi Praktikum SFB (Genap)Document25 pagesFormat Laporan Resmi Praktikum SFB (Genap)Lani PuspitaNo ratings yet
- Jurnal Pembuatan N-Butil BromidaDocument6 pagesJurnal Pembuatan N-Butil BromidaDelisa Rizkiani100% (1)
- Soal TermodinamikaDocument4 pagesSoal TermodinamikaDamar Agung T100% (1)
- SISTEM TIGA KOMPONENDocument6 pagesSISTEM TIGA KOMPONENNahzim RahmatNo ratings yet
- Laporan SikloheksanolDocument10 pagesLaporan SikloheksanolAhmadiansyahNo ratings yet
- PANAS PEMBAKARANDocument16 pagesPANAS PEMBAKARANRidho van HertaNo ratings yet
- FAC-MERDocument25 pagesFAC-MERHamdan Nurul FikriNo ratings yet
- Kesetimbangan FaseDocument11 pagesKesetimbangan FaseIntan Rizki HayuningtyasNo ratings yet
- OPTIMIZED TITLEDocument8 pagesOPTIMIZED TITLEAtika OktrimaNo ratings yet
- Laporan Praktikum Kimia Fisik E-2 Kelarutan Timbal BalikDocument22 pagesLaporan Praktikum Kimia Fisik E-2 Kelarutan Timbal BalikCatia Julie Aulia100% (1)
- Bundelan Objek 5 Lengkap YuliDocument32 pagesBundelan Objek 5 Lengkap YuliCitra Ilham Maulana0% (1)
- MSDS Asam AsetatDocument4 pagesMSDS Asam AsetatAyuh Pangudi WidyasariNo ratings yet
- BAB I - Diagram TernerDocument3 pagesBAB I - Diagram TernerEstiningtyas Kusuma WardaniNo ratings yet
- MSDS CuSO4 Versi Bhs IndonesiaDocument6 pagesMSDS CuSO4 Versi Bhs IndonesiaIsmail NurNo ratings yet
- Analisis Cis-TransDocument23 pagesAnalisis Cis-TransKurniawatiNo ratings yet
- Msds Perc - XiDocument9 pagesMsds Perc - XiFauzi AbdilahNo ratings yet
- ENTALPI DAN ENTROPIDocument15 pagesENTALPI DAN ENTROPIria hikmarinaNo ratings yet
- Msds Petroleum Ether 40-60Document11 pagesMsds Petroleum Ether 40-60Rahmad Fajar Tanjung100% (2)
- TUGAS HI Debu Barium Sulfat-2 Dengan Gambar-TambahanDocument4 pagesTUGAS HI Debu Barium Sulfat-2 Dengan Gambar-TambahanRyma Sriayu WulandariNo ratings yet
- Hukum GibbsDocument1 pageHukum GibbsYayan FunkNo ratings yet
- Kesetimbangan FasaDocument9 pagesKesetimbangan FasaAnnisaNo ratings yet
- Tugas Mata Kuliah Kimia DasarDocument22 pagesTugas Mata Kuliah Kimia DasarWiwin Faristin100% (1)
- Energi GibbsDocument5 pagesEnergi Gibbsriska fitrianiNo ratings yet
- Energi Bebas Gibs - DefinisiDocument6 pagesEnergi Bebas Gibs - DefinisiUci RahmadaniNo ratings yet
- Energy and Exergy Balances For Modern DieselDocument1 pageEnergy and Exergy Balances For Modern DieselSyarif MuhammadNo ratings yet
- Tugas 1 CNCDocument8 pagesTugas 1 CNCSyarif MuhammadNo ratings yet
- Cover Tugas KINDINDocument1 pageCover Tugas KINDINSyarif MuhammadNo ratings yet
- 2 1404117882 001017 DEME BELI ASAW - Desain Meja BeDocument23 pages2 1404117882 001017 DEME BELI ASAW - Desain Meja BeSyarif MuhammadNo ratings yet
- Proposal Proposal Uji Eksperimental Number of SC PDFDocument30 pagesProposal Proposal Uji Eksperimental Number of SC PDFSyarif MuhammadNo ratings yet
- Cover Tugas KINDINDocument1 pageCover Tugas KINDINSyarif MuhammadNo ratings yet
- Sebelum TurbochargerDocument12 pagesSebelum TurbochargerSyarif MuhammadNo ratings yet
- Proposal SkripshitDocument18 pagesProposal SkripshitSyarif MuhammadNo ratings yet
- Presentasi ExergyDocument19 pagesPresentasi ExergySyarif MuhammadNo ratings yet
- Presentasi ExergyDocument19 pagesPresentasi ExergySyarif MuhammadNo ratings yet
- Benda Kerja 2dDocument1 pageBenda Kerja 2dSyarif MuhammadNo ratings yet
- Muhammad Syarif - TranslateDocument11 pagesMuhammad Syarif - TranslateSyarif MuhammadNo ratings yet
- Gaya Antar MolekulDocument4 pagesGaya Antar MolekulSyarif MuhammadNo ratings yet
- Jurnal Konsep Diri Dan Self Disclosure Remaja Broken HomeDocument17 pagesJurnal Konsep Diri Dan Self Disclosure Remaja Broken HomeSyarif Muhammad50% (2)
- Jenis Conveyor RollerDocument3 pagesJenis Conveyor RollerSyarif MuhammadNo ratings yet
- Tugas Ke-1Document3 pagesTugas Ke-1Syarif MuhammadNo ratings yet
- Fungsi Gamma Dan BetaDocument20 pagesFungsi Gamma Dan BetaSyarif MuhammadNo ratings yet
- PR02 GBTR GBDRDocument6 pagesPR02 GBTR GBDRSyarif MuhammadNo ratings yet
- Tugas AkhirDocument3 pagesTugas AkhirSyarif MuhammadNo ratings yet
- Profil PT. Karya Mas EnergiDocument3 pagesProfil PT. Karya Mas EnergiSyarif MuhammadNo ratings yet
- Pemanfaatan LNG Sebagai Sumber Energi Di IndonesiaDocument7 pagesPemanfaatan LNG Sebagai Sumber Energi Di IndonesiaSyarif MuhammadNo ratings yet
- Internal Combustion EngineDocument2 pagesInternal Combustion EngineSyarif MuhammadNo ratings yet
- Tugas Peralatn PabrikDocument6 pagesTugas Peralatn PabrikSyarif MuhammadNo ratings yet
- Faktor Yang Mempengaruhi Permintaan UangDocument65 pagesFaktor Yang Mempengaruhi Permintaan UangSyarif MuhammadNo ratings yet
- Penerapan Kendali Cerdas Pada Sistem Tangki AIr 30-99-1-PBDocument13 pagesPenerapan Kendali Cerdas Pada Sistem Tangki AIr 30-99-1-PBsurenderrrNo ratings yet
- Sifat Mekanik LogamDocument27 pagesSifat Mekanik LogamrizkimeiNo ratings yet
- Toleransi (Tugas)Document14 pagesToleransi (Tugas)Syarif MuhammadNo ratings yet
- Bahan Kuliah 3Document27 pagesBahan Kuliah 3Vyethaa JayantriNo ratings yet
- Publikasi1 87002 700Document8 pagesPublikasi1 87002 700Syarif MuhammadNo ratings yet