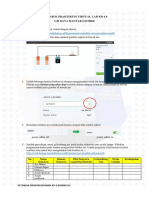
Professional Documents
Culture Documents
Senyawa Polar Dan Non Polar
Uploaded by
haryanto2558Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Senyawa Polar Dan Non Polar
Uploaded by
haryanto2558Copyright:
Available Formats
MODUL PRAKTIKUM
SENYAWA POLAR DAN NON POLAR
PENINGKATAN IMTAQ
Artinya : Sesungguhnya Kami telah mengutus rasul-rasul Kami dengan membawa bukti-
bukti yang nyata dan telah Kami turunkan bersama mereka Al Kitab dan neraca
supaya manusia dapat melaksanakan keadilan. Dan Kami ciptakan besi yang
padanya terdapat kekuatan yang hebat dan berbagai manfaat bagi manusia,
dan supaya Allah mengetahui siapa yang menolong Nya dan rasul-rasul-Nya
padahal Allah tidak dilihatnya. Sesungguhnya Allah Maha Kuat lagi Maha
Perkasa. (QS Al- Hadiid : 25)
Kompetensi Dasar: Mendeskripsikan kemungkinan terjadinya ikatan kimia dengan
menggunakan table periodic
Indikator : Menyelidiki kepolaran beberapa senyawa dan hubungannya dengan
keelektronegatifan melalui percobaan.
I. TUJUAN
Mengidentifikasi senyawa polar dan non polar
II. TEORI
Faktor-faktor yang mempengaruhi kepolaran suatu senyawa :
1. Perbedaan keelektronegatifan
Senyawa yang ion-ionnya membentuk 2 kutub dengan muatan yang
berlawanan ( δ+ dan δ-) menyebabkan terbentuknya suatu dipol. Semakin
besar perbedaan keelektronegatifan atom-atom dalam suatu molekul,
menyebabkan molekul tersebut bersifat semakin polar.
Contoh : HCl keelektronegatifan H=2,1 dan Cl=2,8 maka H cenderung
bermuatan positif (H+) dan Cl cenderung bermuatan negatif (Cl-),
sehingga terjadi 2 kutub (dipol).
Catatan : Jika dicampurkan dengan pelarut akan larut.
Jika senyawa yang ion-ionnya bermuatan sama (δ+ dan δ+) atau (δ- dan δ-)
tidak ada perbedaan keelektronegatifan (perbedaan keelektronegatian = 0),
sehingga tidak terbentuk muatan / dipol. Jika dilarutkan terjadi pengendapan.
SMU ISLAM AL-AZHAR BSD
MODUL PRAKTIKUM
Senyawa yang tidak memiliki perbedaan keelektronegatifan disebut senyawa
non-polar. Contoh : Cl2 , I2, Br2.
2. Pengaruh bentuk molekul
Senyawa yang memiliki bentuk molekul simetris bersifat non-polar.
Contoh : CH4 , CCl4, dsb.
Senyawa yang memiliki bentuk molekul tidak simetris karena ada pasangan
electron bebas (PEB) bersifat polar.
Contoh : NH3, H2O, PCl3, dsb.
III. METODOLOGI PERCOBAAN
3.1. ALAT DAN BAHAN
a. Beaker glass
b. Spatula
c. Pengaduk
d. H2O (air)
e. HCl (asam klorida)
f. NaCl (natrium klorida)
g. I2 (yodida)- Br2 (bromida) dan CCl4 (karbon tetraklorida)
3.2. METODE
a. Masukkan 25 ml air ke dalam beaker glass.
b. Masukkan 1 sendok HCl (asam klorida) ke dalam beaker glass aduk secara
konstan, kemudian biarkan beberapa saat.
c. Amati hasil reaksi ! Apakah ada endapan atau tidak. Jika tidak terbentuk
endapan berarti senyawa tersebut bersifat polar, jika terbentuk endapan,
berarti senyawa tersebut bersifat non-polar.
d. Ulangi langkah a - c untuk senyawa lain.
3.3. TABEL DATA PENGAMATAN
NO SENYAWA OBSERVASI SIFAT
POLAR NON-POLAR
1 HCl Endapan/ larut. √
2 NaCl
3 H2O
4 I2
5 Br2
6 CCl4
7 MgO
SMU ISLAM AL-AZHAR BSD
MODUL PRAKTIKUM
IV. ANALISA HASIL PERCOBAAN
Contoh :
HCl merupakan senyawa yang bersifat polar karena membentuk 2 kutub yang
memiliki perbedaan keelektronegatifan ( lihat table periodic H=2,1 dan Cl=2,9).
V. KESIMPULAN
Klasifikasikan senyawa sesuai percobaan yang termasuk polar dan non-polar.
LAMPIRAN
1. Isilah table berikut
NO SENYAWA KEELEKTRONEGATIFAN MUATAM
+ -
1 HcL
2 NaCl
3 I2
4 Br2
2. Tuliskan reaksi (gunakan struktur lewis)
a. H2O
b. CCl4
c. MgO
SMU ISLAM AL-AZHAR BSD
You might also like
- POLAR DAN NONPOLARDocument9 pagesPOLAR DAN NONPOLARWahyuni Minangkabau100% (1)
- Larutan Elektrolit Dan Non ElektrolitDocument14 pagesLarutan Elektrolit Dan Non ElektrolitAndi Farhan SappewaliNo ratings yet
- Lks Pembuatan KoloidDocument4 pagesLks Pembuatan KoloidMuhammad ZulfanNo ratings yet
- Belerang Kel 3Document14 pagesBelerang Kel 3dwi setyaNo ratings yet
- MAKALAH ElektrokimiaDocument21 pagesMAKALAH ElektrokimiaShr Laa TakhofNo ratings yet
- POLAR DAN NON POLARDocument13 pagesPOLAR DAN NON POLARNadia Iska MaritoNo ratings yet
- 5-4-Konsentrasi Larutan Dalam Satuan KimiaDocument7 pages5-4-Konsentrasi Larutan Dalam Satuan KimiaAlda SeptaNo ratings yet
- OPTIMALKAN KIMIADocument27 pagesOPTIMALKAN KIMIADahvia Arisma WidiastiniNo ratings yet
- IKATAN KIMIADocument50 pagesIKATAN KIMIAArief DwiyantoNo ratings yet
- Reduktor Dan OksidatorDocument6 pagesReduktor Dan OksidatorWwJd HeavenNo ratings yet
- Asam BasaDocument46 pagesAsam BasaRpdjaNo ratings yet
- Analisis Konsep ElektrokimiaDocument8 pagesAnalisis Konsep ElektrokimiaarwantoNo ratings yet
- Penyetaraan Reaksi RedoksDocument8 pagesPenyetaraan Reaksi RedoksAlex KanathNo ratings yet
- TUGAS-1 Kimia Kualitatif - Muhammad Naufal PashaDocument2 pagesTUGAS-1 Kimia Kualitatif - Muhammad Naufal PashaMaswarnieNo ratings yet
- Woro XI Modul Kesetimbangan KimiaDocument37 pagesWoro XI Modul Kesetimbangan KimiaNurmelia NurmeliaNo ratings yet
- RPP UJIAN Praktikum Kovalen Polar Dan NonpolarDocument25 pagesRPP UJIAN Praktikum Kovalen Polar Dan NonpolarkhusnullusiNo ratings yet
- Syamsidar-Dasar Reaksi Kimia OrganikDocument197 pagesSyamsidar-Dasar Reaksi Kimia OrganikMuhammad FaisalNo ratings yet
- Modul Praktikum Kimia Organik 2023Document42 pagesModul Praktikum Kimia Organik 2023sman1pobimantararisqiNo ratings yet
- Bahan Ajar Laju ReaksiDocument19 pagesBahan Ajar Laju Reaksidheny27100% (1)
- Bab 1.ikatan KimiaDocument35 pagesBab 1.ikatan KimiaandyNo ratings yet
- Laju ReaksiDocument12 pagesLaju ReaksiYunita Hamsari0% (1)
- Makalah Asam BasaDocument17 pagesMakalah Asam BasaTeuku Bayu AnggaraNo ratings yet
- UKB KIM - Gaya AntarmolekulDocument9 pagesUKB KIM - Gaya AntarmolekulInggit100% (1)
- 1.sifat Koligatif Larutan - PowerpointDocument33 pages1.sifat Koligatif Larutan - PowerpointMachmud AminudinNo ratings yet
- Program Semester 2Document3 pagesProgram Semester 2Eko Budi Prasetyo NugrohoNo ratings yet
- 2 - Laporan Modul 3 Reaksi-Reaksi Kimia (Risti Wulandari 1830190)Document8 pages2 - Laporan Modul 3 Reaksi-Reaksi Kimia (Risti Wulandari 1830190)Epi AmaliahNo ratings yet
- POLAR VS NON POLARDocument12 pagesPOLAR VS NON POLARNadia Iska MaritoNo ratings yet
- PERUBAHAN ENTALPIDocument8 pagesPERUBAHAN ENTALPIJasmine MelatiNo ratings yet
- Laporan Praktikum TitrasiDocument13 pagesLaporan Praktikum TitrasiKristin_Dans_8021No ratings yet
- Laju ReaksiDocument19 pagesLaju ReaksiKopitesNo ratings yet
- RPP StoikiometriDocument3 pagesRPP StoikiometriAfifah S NNo ratings yet
- Buku Kimia Organik FennyDocument79 pagesBuku Kimia Organik Fennympakih.banjarNo ratings yet
- Kimia OsmosisDocument29 pagesKimia OsmosisAnonymous Y1Kl9nVG00No ratings yet
- ALKANA DI ALAMDocument25 pagesALKANA DI ALAMLucyanaDkNo ratings yet
- BENTUK MOLEKULDocument16 pagesBENTUK MOLEKULYulida erdaniNo ratings yet
- Makalah Reaksi RedoksDocument12 pagesMakalah Reaksi RedoksFielda Ayu Amasfa100% (2)
- Tata Nama HidrokarbonDocument5 pagesTata Nama HidrokarbonpuspitadewiNo ratings yet
- KoloidDocument22 pagesKoloidAmanatur RoviqohNo ratings yet
- KimiaDocument10 pagesKimiaMahdis MNo ratings yet
- Laporan Percobaan 6 Rekristalisasi Garam KrosokDocument6 pagesLaporan Percobaan 6 Rekristalisasi Garam KrosokfitriarizkianaNo ratings yet
- KELARUTAN DAN HASIL KALI KELARUTANDocument20 pagesKELARUTAN DAN HASIL KALI KELARUTANNandha Van SolangNo ratings yet
- Titrasi KompleksometriDocument36 pagesTitrasi KompleksometriRizky AmeliaNo ratings yet
- Entalpi Pembakaran & PenetralanDocument6 pagesEntalpi Pembakaran & PenetralanKhusnul Fika AshariNo ratings yet
- PDF Rencana Pelaksanaan Pembelajaran RPP Bab Polimer KimiaDocument14 pagesPDF Rencana Pelaksanaan Pembelajaran RPP Bab Polimer KimiaEzil Gustia100% (1)
- Laporan Praktikum Indikator Asam & BasaDocument9 pagesLaporan Praktikum Indikator Asam & Basatrias_doraemonNo ratings yet
- LKPD_VIRTUAL_LABDocument141 pagesLKPD_VIRTUAL_LABRiduanNo ratings yet
- Laporan Larutan PenyanggaDocument40 pagesLaporan Larutan PenyanggaNlp Santika Dewi100% (2)
- Kimia OrganikDocument15 pagesKimia OrganikTian NugrahaNo ratings yet
- 4.8 Elektrolit Dan Non (Virtual Lab)Document2 pages4.8 Elektrolit Dan Non (Virtual Lab)Elvina Tri HartantiNo ratings yet
- Bentuk Molekul Dan Gaya AntarDocument11 pagesBentuk Molekul Dan Gaya AntarAyahcintabundaNo ratings yet
- Hukum DaltonDocument15 pagesHukum Daltonlhphay100% (1)
- ALKANAL-ALKANONDocument8 pagesALKANAL-ALKANONYulida erdaniNo ratings yet
- INTERAKSI ANTAR PARTIKELDocument11 pagesINTERAKSI ANTAR PARTIKELULFA TUFFAHATI100% (1)
- SEJARAH ALFRED WERNERDocument20 pagesSEJARAH ALFRED WERNERFrengky AfrimirzaNo ratings yet
- KIMIA ANORGANIK BESIDocument2 pagesKIMIA ANORGANIK BESIst nurdia hasmaNo ratings yet
- pH Campuran Asam BasaDocument10 pagespH Campuran Asam BasaAdela Rizka SuwandaNo ratings yet
- KSP OFiDocument19 pagesKSP OFirabiantiNo ratings yet
- Kation Gol IDocument62 pagesKation Gol INayspisces Nyea Noelupthflentthea0% (1)
- Laporan Senyawa KlorDocument13 pagesLaporan Senyawa KlorSusi AmooreaNo ratings yet
- Laprak Kidas Modul 1 16622226 - DamaDocument8 pagesLaprak Kidas Modul 1 16622226 - DamasiuuuNo ratings yet
- Kekekalan MomentumDocument3 pagesKekekalan Momentumharyanto2558100% (4)
- Medan MagnetDocument3 pagesMedan Magnetharyanto2558100% (2)
- Induksi MagnetikDocument3 pagesInduksi Magnetikharyanto2558100% (2)
- TermokimiaDocument3 pagesTermokimiaharyanto2558100% (3)
- Penentuan Orde ReaksiDocument3 pagesPenentuan Orde Reaksiharyanto2558100% (2)
- Hukum HookeDocument3 pagesHukum Hookeharyanto2558100% (2)
- KapasitorDocument3 pagesKapasitorharyanto2558100% (2)
- Sel VoltaDocument3 pagesSel Voltaharyanto2558100% (2)
- Sifat Koligatif LarutanDocument4 pagesSifat Koligatif Larutanharyanto2558100% (4)
- Pengaruh Konsentrasi Terhadap Daya Hantar ListrikDocument4 pagesPengaruh Konsentrasi Terhadap Daya Hantar Listrikharyanto2558100% (2)
- Pertumbuhan & PerkembanganDocument3 pagesPertumbuhan & Perkembanganharyanto2558100% (2)
- Pergeseran KesetimbanganDocument3 pagesPergeseran Kesetimbanganharyanto2558100% (2)
- Gel Om BangDocument3 pagesGel Om Bangharyanto2558100% (2)
- Laju ReaksiDocument4 pagesLaju Reaksiharyanto2558100% (3)
- Transportasi Pada TumbuhanDocument3 pagesTransportasi Pada Tumbuhanharyanto2558100% (2)
- Besaran Dan SatuanDocument3 pagesBesaran Dan Satuanharyanto2558100% (2)
- Hukum LavoiserDocument3 pagesHukum Lavoiserharyanto2558100% (2)
- Air KristalisasiDocument2 pagesAir Kristalisasiharyanto2558100% (2)
- Gerak Lurus Berubah BeraturanDocument3 pagesGerak Lurus Berubah Beraturanharyanto2558100% (2)
- ElektrolisisDocument3 pagesElektrolisisharyanto2558100% (2)
- Gelombang Dan BunyiDocument3 pagesGelombang Dan Bunyiharyanto2558100% (2)
- Gaya Pada Bidang MiringDocument4 pagesGaya Pada Bidang Miringharyanto2558100% (2)