Professional Documents
Culture Documents
Azas Black
Uploaded by
Fristaline Ayu NugraenyCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Azas Black
Uploaded by
Fristaline Ayu NugraenyCopyright:
Available Formats
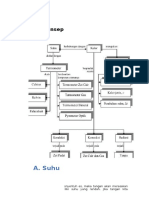
Asas Black adalah suatu prinsip dalam termodinamika yang dikemukakan oleh Joseph Black.
Asas ini menjabarkan: y y y Jika dua buah benda yang berbeda yang suhunya dicampurkan, benda yang panas memberi kalor pada benda yang dingin sehingga suhu akhirnya sama Jumlah kalor yang diserap benda dingin sama dengan jumlah kalor yang dilepas benda panas Benda yang didinginkan melepas kalor yang sama besar dengan kalor yang diserap bila dipanaskan
Rumus Asas Black = (M1 X C1) (T1-Ta) = (M2 X C2) (Ta-T2) Catatan : M1 = Massa benda yang mempunyai tingkat temperatur lebih tinggi C1 = Kalor jenis benda yang mempunyai tingkat temperatur lebih tinggi Ta = Temperatur benda yang mempunyai tingkat temperatur lebih tinggi T1 = Temperatur akhir pencampuran kedua benda M2 = Massa benda yang mempunyai tingkat temperatur lebih rendah C2 = Kalor jenis benda yang mempunyai tingkat temperatur lebih rendah T2 = Temperatur benda yang mempunyai tingkat temperatur lebih rendah Example: Asas Black dapat diartikan sebagai kalor yang diterima sama dengan kalor yang dilepaskan. Dengan kata lain, kalor yang diterima berarti zat tersebut suhunya rendah dan kalor yang dilepaskan berarti zat tersebut suhunya tinggi. Rumus Asas Black:
Contoh soal: Alkohol yang massanya 50 gram dan suhunya adalah 66,3C dimasukkan ke dalam air yang massanya adalah 75 gram dan suhunya adalah 21,9C. Kalor jenis alkohol = 2,4 J/gC dan kalor jenis air = 4,2 J/gC. Berapakah suhu akhir campuran itu? Jawab: Q_terima = Q_lepas m * c * t terima = m * c * t lepas 50 * 2,4 * (66,3 - t_A) = 75 * 4,2 * (t_A - 21,9) 120 * (66,3 - t_A) = 315 * (t_A - 21,9) 7.956 - 120t_A = 315t_A - 6.898,5
7.956 + 6.898,5 = 315t_A + 120t_A 14.854,5 = 435t_A t_A = 34,15C
Sebanyak 25 gram es yang suhunya 0oC ditambahkan ke dalam 100 gram H2O cair pada suhu 22oC di dalam suatu bejana yang diisolasi (kalor tidak dapat keluar bejana). Kalor lebur es adalah 6,02 kJ/mol dan kalor jenis air = 4,18 o J/g C. Bila keadaan akhir telah tercapai apakah seluruhnya air atau campuran es dan air?
Jawaban: Misalkan kalor yang diserap ketika es mencair sebagai Qes, dan kalor yang dilepas H2O (l) sebagai Qair.
Qes = 25 g Es x 1 mol Es x 6,02 kJ = 8,36 kJ 18 g Es 1 mol Es
Jumlah kalor maksimum yang dilepas H2O cair (penurunan suhu maksimum adalah dari 22 C menjadi 0 C):
Qair = 100 g air x 4,18 J/g air oC x (0-22)oC = -9196 J = - 9,20 kJ
Jumlah kalor maksimum yang dibebaskan dalam proses pendinginan air lebih besar daripada yang diperlukan o untuk mencairkan semua es, sehingga pada keadaan akhir semuanya berupa air dengan suhu sedikit di atas 0 C. Suhu campuran dapat dihitung dari:
Qes + Qair = 8,36 kJ 9,20 kJ = -0,84 kJ = 840 J
Anggaplah bahwa 840 J adalah kalor yang diserap oleh 125 g air (es + air) pada 0oC. Berdasarkan anggapan ini suhu akhir dapat dihitung dengan mudah dan akan didapat 1,6oC.
You might also like
- Asas BlackDocument7 pagesAsas BlackLolliNo ratings yet
- Asas BlackDocument7 pagesAsas BlackMuliansyah Nihin100% (1)
- Materi Asas Black-1 PDFDocument7 pagesMateri Asas Black-1 PDFVioNo ratings yet
- JUDULDocument18 pagesJUDULFarisdaNo ratings yet
- Suhu Dan KalorDocument5 pagesSuhu Dan KalordesyaulianabaNo ratings yet
- Asas BlackDocument9 pagesAsas BlackgirinitaNo ratings yet
- Asas BlackDocument6 pagesAsas BlackNanang SofiyullahNo ratings yet
- Azas Black 7Document4 pagesAzas Black 7adenurositaNo ratings yet
- Asas Blac1Document5 pagesAsas Blac1Putu Atmaka PredhanaNo ratings yet
- UNTUK MATERI FISIKADocument13 pagesUNTUK MATERI FISIKATae OxoNo ratings yet
- Asas BlackDocument3 pagesAsas BlackNight MareNo ratings yet
- Asas BlackDocument15 pagesAsas BlackMemin SetoNo ratings yet
- Pernahkah Kita Memperhatikan Ibu Kita Yang Menyiapkan Air Hangat Untuk MandiDocument3 pagesPernahkah Kita Memperhatikan Ibu Kita Yang Menyiapkan Air Hangat Untuk MandiNuri SahinNo ratings yet
- Asas Black Coba CobaDocument16 pagesAsas Black Coba CobaPrayoga Dwi BagaskaraNo ratings yet
- Azas Black dan Contoh PenerapannyaDocument3 pagesAzas Black dan Contoh PenerapannyaadenurositaNo ratings yet
- Materi Fisika Kelas Xi Tentang KalorDocument14 pagesMateri Fisika Kelas Xi Tentang KalorDeeNo ratings yet
- KALOR DAN PERPINDAHANNYADocument4 pagesKALOR DAN PERPINDAHANNYAErina RahmahNo ratings yet
- Suhu Dan KalorDocument26 pagesSuhu Dan KalorYhaa JengNo ratings yet
- Asas Blac1Document5 pagesAsas Blac1yoantheasyNo ratings yet
- TP BAB 5 - Sholeh Hudin - 181920101023Document9 pagesTP BAB 5 - Sholeh Hudin - 181920101023Hudien SholehNo ratings yet
- Konsep Kalor dan Perubahan Wujud ZatDocument7 pagesKonsep Kalor dan Perubahan Wujud ZatDelfyNo ratings yet
- Lap or AnDocument17 pagesLap or AnNifan SabarNo ratings yet
- 6 Kalor Lebur EsDocument12 pages6 Kalor Lebur EsFajar Rumanto50% (2)
- 0 Praktikum FisikaDocument12 pages0 Praktikum FisikaDinda rahardjo98No ratings yet
- BAB 4 Suhu, Pemuaian, KalorDocument33 pagesBAB 4 Suhu, Pemuaian, KalorFadhilah Utami ANo ratings yet
- OPTIMASI ASAS BLACKDocument4 pagesOPTIMASI ASAS BLACKWidya20No ratings yet
- Suhu Dan KalorDocument50 pagesSuhu Dan KalorAnonymous RD17yqWjqNo ratings yet
- Azaz BlackDocument6 pagesAzaz BlackEllia WahyuniNo ratings yet
- FASA-MOLEKULDocument5 pagesFASA-MOLEKULWakhid KusumawardhanaNo ratings yet
- SUHU DAN KALOR FISIKADocument7 pagesSUHU DAN KALOR FISIKAtio fadlyNo ratings yet
- Bab 6 Suhu & KalorDocument23 pagesBab 6 Suhu & KalorZidanFajarMuhammadNo ratings yet
- KalorDocument64 pagesKalorIswahyono SyafNo ratings yet
- Konversi Suhu 4 SkalaDocument14 pagesKonversi Suhu 4 SkalaImron SanjayaNo ratings yet
- Bab 4. Suhu Dan KalorDocument9 pagesBab 4. Suhu Dan KalorNisa AmaliyaNo ratings yet
- Asas BlackDocument9 pagesAsas BlackIka Fatmawati100% (1)
- Diagram Fase Dan Perubahan Wujud Asas BlackDocument13 pagesDiagram Fase Dan Perubahan Wujud Asas BlackBagusNo ratings yet
- ASAS BLACK DAN RUMUSNYADocument4 pagesASAS BLACK DAN RUMUSNYArhiecky100% (1)
- OPTIMALKAN KALORDocument26 pagesOPTIMALKAN KALORkenny nathanaelNo ratings yet
- Laporan Praktikum Asas BlackDocument7 pagesLaporan Praktikum Asas BlackNurRohmahamdani86% (7)
- OPTIMASI KALOR DAN PEMUAIANDocument16 pagesOPTIMASI KALOR DAN PEMUAIANfriskaayuNo ratings yet
- Azas Black KimiaDocument8 pagesAzas Black KimiaNico IvanandaNo ratings yet
- Fisika5 - SUHU & KALORDocument30 pagesFisika5 - SUHU & KALORojaNo ratings yet
- Makalah Fisika Suhu Kalor Dan Perpindahan KalorDocument12 pagesMakalah Fisika Suhu Kalor Dan Perpindahan KalorShilvy MailidaNo ratings yet
- Pengertian Suhu Dan KalorDocument25 pagesPengertian Suhu Dan KalorDimas LukitoNo ratings yet
- KAPASITAS PANASDocument7 pagesKAPASITAS PANASAeniNo ratings yet
- SUHU DAN KALORDocument22 pagesSUHU DAN KALORRezita RamadhaniNo ratings yet
- 10 KalorDocument17 pages10 KalorIndriNo ratings yet
- Tugas Pendahuluan Fisika 1Document3 pagesTugas Pendahuluan Fisika 1AzizahNo ratings yet
- Suhu Dan Kalor NewDocument40 pagesSuhu Dan Kalor NewyuliagitaadityaNo ratings yet
- Jawaban TP Fisika KalorimeterDocument5 pagesJawaban TP Fisika KalorimeterMuh Sigit Saputra HastaNo ratings yet
- KALORDocument10 pagesKALORYudi SaputraNo ratings yet
- Kalor (Kuantitatif)Document20 pagesKalor (Kuantitatif)FasihaNo ratings yet
- 10 KalorDocument17 pages10 KalorHoer MutaqinNo ratings yet
- KalorDocument10 pagesKalorAgung Fitria NugrahaNo ratings yet
- Azas BlackDocument24 pagesAzas BlackFerdi FredikNo ratings yet
- Suhu Dan Kalor (Fisika XI Semester 1)Document20 pagesSuhu Dan Kalor (Fisika XI Semester 1)Fira Widyananda Aslama100% (1)
- Suhu-Kalor-Dan-Pemuaian-1-Dikonversi PDFDocument70 pagesSuhu-Kalor-Dan-Pemuaian-1-Dikonversi PDFArlandNo ratings yet
- Bab 2 - Alkitab Firman AllahDocument6 pagesBab 2 - Alkitab Firman AllahFristaline Ayu Nugraeny100% (1)
- Bab 1-Tujuan Hidup Yang BaruDocument3 pagesBab 1-Tujuan Hidup Yang BaruFristaline Ayu NugraenyNo ratings yet
- CENTER VS CENTRALIZERDocument3 pagesCENTER VS CENTRALIZERFristaline Ayu NugraenyNo ratings yet
- Aturan Kosinus-By RIKADocument6 pagesAturan Kosinus-By RIKAFristaline Ayu NugraenyNo ratings yet
- Chapter IIDocument18 pagesChapter IIAlfiSyahryNo ratings yet
- Gerak Lurus Berubah Beraturan (GLBBDocument30 pagesGerak Lurus Berubah Beraturan (GLBBFristaline Ayu NugraenyNo ratings yet
- Kegunaan DimensiDocument3 pagesKegunaan DimensiFristaline Ayu NugraenyNo ratings yet