Professional Documents
Culture Documents
KIMIA ANALISIS
Uploaded by
Mustakim Masnur Al BiruniOriginal Description:
Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
KIMIA ANALISIS
Uploaded by
Mustakim Masnur Al BiruniCopyright:
Available Formats
LAPORAN LENGKAP PRAKTIKUM KIMIA ANALISIS FARMASI
OLEH KELOMPOK GOLONGAN : I (SATU) : II (DUA)
LABORATORIUM KIMIA FARMASI JURUSAN FARMASI FIKES UNIVERSITAS ISLAM NEGERI ALAUDDIN MAKASSAR SAMATA GOWA 2011
BAB I PENDAHULUAN A. Latar belakang Kimia analitik pada dasarnya menyangkut penentuan komposisi kimiawi suatu materi. Dahulu hal tersebut adalah tujuan utama seorang ahli kimia anaitik. Tetapi dalam kimia analitik modern, aspek-aspeknya juga meliputi identifikasi suatu zat, elusidasi struktur dan analisa kuantitatif komposisinya. Dalam analisa kimia farmasi kuantitatif, dikenal dua metode yakni analisis gravimetric dan analisis titrimetri. Pada percobaan ini yang dilakukan adalah analisis titrimetrik. Dimana, metode titrimetri masih digunakan secara luas karena merupakan metode yang tahan, mudah, dan mampu memberikan ketepatan (presisi) yang tinggi. Keterbatasan metode ini adalah bahwa metode titrimetri kurang spesifik. Selanjutnya, salah satu metode titrasi yang akan digunakan adalah reaksi oksidasi-reduksi (redoks). Dasar yang digunakan adalah perpindahan electron. Penetapan kadar senyawa berdasarkan reaksi ini digunakan secara luas seperti permanganometri, serimetri iodo-iodi. Titrasi iodometri digunakan untuk menentukan kadar dari zat-zat uji yang bersifat reduktor dengan titrasi langsung. Sedangkan untuk titrasi iodimetri adalah kebaliknya. Titrasi iodometri-iodimetri ini sering digunakan dalam industri farmasi. Khususnya pada penentuan kadar zat-zat uji yang bersifat reduktor dan oksidator. Adapun dalam farmakope Indonesia, titrasi iodometri digunakan untuk menetapkan kadar dari asam askorbat, natrium askorbat, metampiron (antalgin), natrium tiosulfat, dan lain-lain.
B. Maksud dan tujuan 1. Maksud percobaan Mengetahui dan memahami penentuan kadar suatu senyawa dengan menggunakan metode titrimetri/volumetri. 2. Tujuan percobaan Menentukan kadar vitamin C dengan metode iodimetri, dan menentukan kadar CuSO4.5H2O dengan metode iodometri. C. Prinsip percobaan Penentuan kadar vitamin C berdasarkan reaksi redoks menggunakan metode iodimetri dalam suasana asam, kemudian dititrasi dengan larutan baku iodin dengan penambahan larutan kanji sebagai indikator dan titik akhir titrasi ditandai dengan adanya perubahan warna dari bening menjadi biru kehitaman. Penentuan kadar CuSO4.5H2O berdasarkan reaksi redoks
menggunakan metode iodometri dalam suasana asam dengan penambahan KI, dititrasi dengan larutan baku Na2S2O3 dan penambahan larutan kanji menjelang titik akhir titrasi dan ditandai dengan perubahan warna menjadi biru tepat hilang.
BAB II TINJAUAN PUSTAKA A. Teori umum Reaksi-reaksi kimia yang melibatkan oksidasi-reduksi dipergunakan secara luas oleh analisis titrimetrik. Ion-ion dari beberapa unsure-unsur dapat hadir dalam kondisi oksidator yang berbeda-beda, menghasilkan
kemungkinan banyak reaksi redoks. Banyak dari reaksi-reaksi ini memenuhi syarat untuk dipergunakan dalam analisis titrimetrik dan penerapn. Penerapannya cukup banyak, iodometri adalah salah satu analisa titrimetrik yang secara tidak langsung untuk zat yang bersifat oksidator seperti besi (III), dimana zat ini akan mengoksidasi iodida yang ditambahkan membentuk iodin. Iodine yang terbentuk akan ditentukan dengan menggunakan larutan baku tiosulfat. Oksidasi + KI I2 + Na2S2O3 I2 + 2e NaI + Na2S4O6
Sedangkan iodimetri adalah merupakan analisis titrimetri yang secara langsung digunakana untuk zat indikator tau natrium tiosulfat dengan menggunakan larutan iodine atau dengan penambahan larutan baku berlebihan. Kelebihan iodin atau dengan penambahan larutan baku berlebihan. Kelebihan iodin dititrasi kembali dengan larutan tiosulfat. Reduktor + I2 Na2S2O3 + I2 2INaI + Na2S4O6
Istilah oksidasi mengacu pada setiap perubahan warna dimana terjadi kenaikan bilangan oksidasi, sedangkan reduksi digunakan untuk setiap penurunan bilangan oksidasi. Berarti proses oksidasi disertai bilangan elektron sedangkan reduksi memperoleh elektron. Oksidasi adalah senyawa dimana atom yang terkandung mengalami penurunan bilangan oksidasi. Sebaliknya pada reduktor, atom yang terkandung mengalami kenaikan bilangan oksidasi. Oksidasi-reduksi harus selalu berlangsung bersama dan
saling mengkompersasi satu sama lain. Istilah oksidator-reduktor mengacu kepada suatu senyawa tidak mengacu kepadanya atom saja.(Khopkar.2003; 42) Sistemredoks ion (triiodida-Iodida) I3 + 2e 3I-
mempunyai potensial standar besar +0,54 V. Karena itu, Iodin adalah sebuah pengoksidasi yang juh lebih lemah daripada kalium permanganat. Senyawa serum (IV) dan kalium dikromat. Dilain pihak, ion iodide adalah agem pereduksi yang termasuk kuat. Lebih kuat, sebagai contoh dari pada ion Fe (II). Dalam proses analisis, iodin dipergunakan sebagai agen pengoksidasi (iodimetri). Dapat dikatakan bahwa hanya sedikit substansi yang cukup kuat sebagai reduksi untuk titrasi langsung dengan iodin, karena itu jumlah dari penentuan-penentuan adalah sedikit. Kelarutan iodida adalah serupa dengan klorida dan bromide, perak merkuri (I), merkurium (II) tembaga (I) dan timbal iodida adalah garamgaramnya yang paling sedikit larut. Reaksi-reaksi ini dapat dipelajari dengan larutan kalium iodide 0,1 M. Penggunaan metode titrasi dengan iodida-iodium sering dibagi menjadi dua, yaitu : 1. Titrasi langsung (Iodimetri) Iodium merupakan oksidator yang sedikit/relative kuat dengan nilai potensial oksidasi sebesar +0,535 V. Pada saat reaksi osidasi, iodium akan direduksi menjadi iodide sesuai dengan reaksi : I2 + 2e 2I-
Iodium akan mengoksidasi senyawa-senyawa yang mempunyai potensial reduksi yang lebih kecil dari pada iodium sehingga dapat dilakukan titrasi langsung dengan iodium.
2. Titrasi tidak langsung (Iodometri) Iodometri merupakan titrasi tidak langsung dan digunakan untuk menetapkan senyawa-senyawa yang mempunyai potensial oksidasi yang lebihbesar dari pada sistem Iodium-Iodida atau senyawa-senyawa yang bersifat oksidator, seperti CuSO4.5H2O, garam besi (III), dimana zat-zzat oksidator ini direduksi lebih dulu dengan ICI, dan iodin yang dihasilkan dalam jumlah yang setara ditentukan kembali dengan larutan baku natrium tiosulfat. (Rohman.2007; 105). Larutan iodium sendiri dapat digunakan sebagai indikator suatu tetes larutan iodium 0,1 mL air memberikan warna pucat yang masih dapat diamati. Supaya lebih peka, digunsksn larutan kanji sebagai indicator, dimana kanji dengan iodium membentuk kompleks yang berwarna biru dan masih dapat diamati pada kadar yang sangat rendah. Ada juga dapat bahwa warna biru adalah disebabkan absorbs iodium atau ion triiodia pada permukaan makromolekul kanji. Komponen utama dari kanji ada dua yaitu: amilosa dan amilopektin yang perbandingannya pada setiap tumbuh-tumbuhan berbeda. Amilosa, senyawa yang mempunyai rantai lurus dan dapat banyak/sedikit terdapat dalam kentang dan memberikan rantai bercabang memebentuk warna merah violet, mungkin karena absorbs. Indikator kanji bersifat reversible, artinya warna biru yang timbul akan hilang lagi apabila yodium direduksi oleh natrium tiosulfat atau reduktor lainnya. Selain indikatornya tersebut, maka untuk menetapkan titik akhir titrasi dapat juga digunakan pelarut-pelarut organik ini penting terutama sebagai berikut : Susunan sangat asam sehingga kanji terhidrolisis Titrasi berjalan lambat Larutannya sangat encer
Kerugian pemakaian pelarut organik antara lain : Harus dipakailabu tertutup gelap Harus digojong kuat-kuat untuk memisahkan yodium dari air. (Harjadi.1993; 53) Dalam proses analitik, iodium digunakan sebagai pereaksi oksidasi (iodimetri) dan iodide digunakan sebagai pereaksi reduksi yang cukup kuat untuk titrasi secara langsung dengan iodium. Maka jumlah penentuan iodometri adalah sedikit, akan tetapi banyak pereaksi oksidasi cukup untuk bereaksi sempurna dengan iodida dan ada banyak penggunaan iodimetri. Salah satu kelebihan ion iodida ditambahkan kepada pereaksi oksidasi yang ditentukan dengan pembebasan iodium, yang kemudian dititrasi dengan larutan natrium tiosulfat. Reaksi antara iodium dan tiosulfat berlangsung secara sempurna. (Underwood.1986; 96) Larutan hanya sedikit larut dalam air, tetapi agak sukar larut dalam larutan yang mengandung ion iodida. Larutan iodium standar dapat dibuat dengan menimbang langsung iodium murni dan pengenceran dalam botol volumetric. Iodium dimurnikan dengan cara rublimasi dan ditambahkan dengan larutan KI pekat, yang ditimbang dengan teliti sebelum dan sesudah penambahan iodium. Akan tetapi larutan distandarisasikan dengan suatu standar primer, As2O3 yang paling bias digunakan. (Underwood.1986;78) Larutan standar yang dipergunakan dalam kebanyakan proses iodometrik adalah natrium tiosulfat. Garam ini biasanya tersedia sebagai pentahidrat Na2S2O3.5H2O. Larutan ini tidak boleh distandarisasi dengan penimbangan secara langsung, tetapi harus distandarisasi terhadap standar primer. Larutan natrium tiosulfat tidak stabil untuk waktu yang lama. Sejumlah zat padat digunakan sebagai standar primer untuk larutan natrium tiosulfat iodium murni merupakan standar yang paling nyata, tetapi jarang digunakan karena kesukaran dalam penanganan dan penimbangan, lebih
sering digunakan pereaksi kuat membebaskan iodium dan iodide, suatu proses iodometri. (Underwood.1986.83) Metode titrasi iodometri langsung (kadang-kadang dinamakan iodimetri) mengacu kepada titrasi yaitu larutan iod standar. Metode titrasi iodimetri tak langsung kadang-kadanf dinamakan (iodometri) adalah berkenaan dengan titrasi dari iod yang dibebaskan dari reaksi kimia. Potensial reduksi normal dari sistem reversible. I2(solid) + 2e 2I= 0,5345 Volt
Persamaan diatas mengacu kepada suatu larutan air yang jenuh dengan adanya iod padat. Reaksi sel setengah ini akan terjadi, misalnya menjelang akhir titrasi iodide dengan suatu iod pengoksid seperti kalium permanganate. Ketika konsentrasi ion iodide menjadi relatif rendah. Dekat permulaan atau dalam kebanyakan titrasi iodometri , bila ion iodida terdapat dengan berlebih, maka akan terbentuklah in tri iodida. I2(aq) + Ilebih baik ditulis sebagai I3- + 2e 3II3-
Karena iod mudah larut dalam larutan iodide. Reaksi sel setengah itu
Dalam potensial reduksi standarnya adalah 0,535 Volt. Maka iod atau ion tri-iodida merupakan zat pengoksida yang jauh lebih lemah dibandingkan dengan kalium permanganate,kalium dikromat dan serium (IV) sulfat. (Besset.1994; 34). I2 adalah oksidator lemah sedangkan iodide secara relatife merupakan reduktor lemah. Kelarutannya cukup baik dalam air dengan pembentukan triiodida. Iodium dapat dimurnikan dengan sublimasi, ia larut dalam KI dan harus disimpan dalam tempat yang dingin dan gelap. Berkurangnya iodium akibat penguapan dan oksidasi udara menyebabkan banyaknya kesalahan analisis.
Larutan tiosulfat distandarisasi terlebihdahulu terhadap K2CrO4. Biasanya indicator yang digunakan adalah kanjiamilum. Iodide pada konsentrasi <10-3 M dapat dengan mudah ditekan oleh amilum. Sentivitas warnanya tergantung pada pelarut yang digunakan. Kompleks amiliumiodium mempunyai kelarutan yang kecil dalam air sehingga biasanya ditambahkan pada titik akhir titrasi. (Khopkar. 2008; 126) Penambahan amilum dilakukan setelah adanya warna kuning karena jika amilum ditambahkan pertama kali maka akan terbentuk amilium iodium. Jika amilium iodium terbentuk maka I2 tidak bias direduksi oleh H2SO4. Hal ini akan berakibat warna biru sulit sekali lenyap sehingga titik akhir tidak kelihatan tajam lagi. Bila iod masih banyak sekali bahkan dapat menguraikan amilium dan hasil penguraian ini mengganggu perubahan pada titik akhir sehingga warna kuning dianggap hampir mencapai. B. Uraian bahan 1. Aquadest (Dirjen POM.1979; 96) Nama resmi Nama lain Berat molekul Rumus molekul Pemerian : AQUADESTILLATA : Aquadest : 18,02 : H2O : Cairan jernih, tidak berbau dan tidak berasa, serta tidak berwarna Kelarutan Kegunaan : Larut dalam semua zat : Sebagai pelarut
2. Asam sulfat (Dirjen POM.1979; 58) Nama resmi Nama lain Berat molekul Rumus molekul : ACIDUM SULFURICUM : Asam sulfat : 18,07 : H2SO4
Pemerian
: Cairan kental seperti minyak, korosif, tidak berwarna, jika dipanaskan kedalam air menimbulkan panas
Kelarutan
Bercampur
dengan
air
dan
dengan
etanol,
menimbulakan panas Penyimpana Kegunaan 3. Asam asetat Nama resmi Nama lain Berat molekul Rumus molekul Pemerian : Dalam wadah tertutup rapat : Pemberi suasana Asam (Dirjen POM.1979; 41) : ACIDUM ACETICUM : Asam asetat : 60,05 : CH3COOH : Cairan jernih, tidak berwarna, bau menusuk, rasa asam, tajam. Kelarutan : Dapat bercampur dengan air, etanol (95%) P, dan dengan gliserol P. Penyimpanan Kegunaan : Dalam wadah tertutup rapat : Pemberi suasana asam
4. Asam askorbat (Dirjen POM.1979; 47) Nama resmi Nama lain Berat molekul Rumus molekul Pemerian : ACIDUM ASCORBICUM : Asam askorbat, Vit C : 176,13 : C8H8O6 : Serbuk atau habur, putih atau agak kuning, tidak berbau, rasa asm. Oleh pengaruh cahaya lambat laun menjadi gelap. Dalam keadaan kering. Mantap di udara, dalam larutan cepat teroksidasi.
Kelarutan
: Mudah larut dalam air,agak sukar larut dalam etanol (95%)P, praktis tidak larut dalam kloroform, dalam eter P dan dalam benzene P.
Penyimpanan Kadar
: Dalam wadah tertutup baik, terlindung dari cahaya : Asam askorbat mengandung tidak kurang dari 99,0% C6H8O6
Kegunaan 5. Iodium
: Sebagai sampel Iodimetri
(Dirjen POM.1979; 316) : IODIUM : Iodium : 126,91 : I2 : Keping atau butir, mengkilat seperti logam hitam kelabu, bau khas
Nama resmi Nama lain Berat molekul Rumus molekul Pemerian
Kelarutan
: Sukar larut dalam air, mudah larut dalam garam iodida, mudah larut dalam etanol (95%)
Penyimpanan Kegunaan 6. Kalium iodida Nama resmi Nama lain Berat molekul Rumus molekul Pemerian
: Dalam wadah tertutup rapat : Sebagai larutan baku (Dirjen POM.1979; 330) : KALLI IODIDUM : Kalium iodide : 166,00 : KI : Hablur heksahedral,transparan atau tidak berwarna opak dan putih, atau serbuk butiran putih, higroskopik.
Kelarutan
: Sangat mudah larut dalam air,lebih mudah larut dalam air mendidih
Penyimpana
: Dalam wadah tertutup baik
Kegunaan
: Pemberi I2 : NATRII THIOSULFAS : Natrium tisulfat : 248,17 : Na2C2O3 : Hablur besar tidak berwarna dan serbuk hablur kasar. Dalam udara lembab meleleh basah, dalam hampa udara pada suhu diatas 330 merapuh
7. Natrium tiosulfat (Dirjen POM.1979; 428) Nama resmi Nama lain Berat molekul Rumus molekul Pemerian
Kelarutan
: Larut dalam 0,5 bagian air,praktis tidak larut dalam etanol (95%)
Penyimpana Kegunaan
: Dalam wadah tertutup rapat : Sebagai larutan baku
8. Tembaga (II) sulfat (Dirjen POM.1979; 731) Nama resmi Nama lain Berat molekul Rumus molekul Pemerian Kelarutan : CUPRII SULFAS : Tembaga (II) sulfat : 249,68 : CuSO4.5H2O : Prisma terbalik atau serbuk hablur, biru : Larut dalam 3 bagian air dan 3 bagian gliserol, sangat sukar larut dalam etanol (95%)P Penyimpanan Kadar : Dalam wadah tertutup rapat : Tembaga (II) sulfat mengandung tidak kurang dari 98,5 % dan tidak lebih dari 101,0 % CuSO4.5H2O C. Prosedur kerja 1. Pembuatan dan standarisasi larutan a. Pembuatan larutan baku Iodin 0,1 N Timbang dengan teliti 12,7 Iodin dalam botol timbang, masukkan ke dalam gelas piala. Timbang 18 g KI dan larutkan dalam
50 mL air suling. Tambahkan ke dalam gelas piala yang berisi 12,7 g Iodin, aduk hingga semua iodine larut. Pindahkan ke dalam labu ukur, cukupkan volumenya hingga 1000 mL, lalu homogenkan. Simpan dalam botol tertutup dan berwarna coklat pada tempat yang gelap. b. Satndarisasi larutan Iodin 0,1 N dengan As2O3 Timbang seksama 150 mg As2O3 murni, pindahkan ke dalam gelas piala 400 mL. Larutkan dalam 20 mL NaOH 0,1 N denga sedikit pemanasan. Encerkan dengan 40 mL air suling, tambahkan 2 tetes jingga metil dan tetesi dengan HCl hingga larutan berubah warna dari kuning menjadi jingga. Tambahkan 2 g Natrium Karbonat dan tambahkan 50 mL air suling. Tambahkan 3 mL larutan kanji dan titrasi dengan larutan Iodin hingga warna biru yang stabil. Ualngi perlakuan 2 kali lagi. Hitung normalitas larutan Iodin tersebut. Tiap mL Iodin 0,1 N setara dengan 49,96 mg As2O3 c. Pembuatan larutan baku Na2S2O3 0,1 N Larutkan 25 g Kristal Natrium Tiosulfat pentahidrat ke dalam 1000 mL air yang baru saja didihkan dan didinginkan. Tambahkan 0,2 g Natrium karbonat sebagai pengawet dan simpan dalam sebuah botol yang bersih. d. Standarisasi larutan Na2S2O3 0,1 N dengan K2Cr2O7 Timbang tiga porsi kalium bikromat murni dan kering masingmasing 200 mg, dan masukkan ke dalam Erlenmeyer 500 mL. larutkan dengan 100 mL air suling dan tambahkan 4 mL asam sulfat pekat. Tambhakan 2 g Natrium karbonat, aduk perlahan-lahan. Tambahkan 5 g Kalium Iodida yang dilarutkan dalam 5 mL air. Tutup Erlenmeyer sekitar 3 menit. Encerkan dengan air hingga 200 mL. titrasi dengan Natrium tiosulfat sampai warna kuning dari kuning dari Iodium hampir hilang. Tambahkan 3 mL larutan kanji dan lanjutkan titrasi warna biru hilang. Warna terakhir akan berwarna hijau zamrud jernih.
2. Penetapan sampel a. Penetapan kadar Antalgin dengan Iodimetri Timbang seksama 200 mg antalgin, masukan dalam
Erlenmeyer 250 mL, larutkan dalam 5 mL air suling. Tambahkan 5 mL HCl 0,02 N dan segera titrasi dengan larutan Iodin 0,1 N menggunakan indicator kanji. Kocok sekali-kali hingga terjadi warna biru mantap selama 2 menit. Ulangi perlakuan 2 kali lagi. Hitung kadar antalgin dalam sampel. Tiap mL Iodin 0,1 N setara dengan 16,67 mg C13H16N3NaO4S. b. Penetapan kadar Vitamin C secara Iodometri Timbang teliti 300 mg sampel vitamin C.larutkan dalam 20 mL air yang telah dididihkan dan didinginkan. Tambahkan 5 mL asam sulfat 10 % dan segera tambahkan 50 mL larutan Iodin 0,1 N dan titrasi dengan larutan Natrium tiosulfat dengan menggunakan indikator kanji. Ulangi perlakuan 2 kali lagi,lakukan juga penetapan blanko. Hitung kadar vitamin C dalam sampel. Tiap mL I2 0,1 N setara dengan 8,8 mg Vitamin C c. Penetapan kadar CuSO4 secara Iodometri Timbang seksama 1 g garam terusi, larutkan dalam 50 mL air suling, tambahan 4 mL asam asetat dan 3 g KI. Titrasi Iodin yang bebas dengan larutan Natrium tiosulfat 0,1 N menggunakan indikator kanji. Ulangi perlakuan 2 kali lagi, dihitung kadar CuSO4 dalam sampel. Tiap mL Na2S2O3 0,1 N setara dengan 24,97 CuSO4.5H2O
BAB III METODE KERJA A. Alat dan bahan Adapun alat yang digunakan adalah buret, erlenmeyer, gelas kimia, gelas ukur, neraca analitik, pipet tetes, statif dan klem, sendok tanduk, kompor listrik. Bahan yang digunakan adalah aluminium foil, aquadest, asam asetat, asam sulfat 10 %, CuSO4.5H2O, indicator kanji, kertas perkamen, KI, larutan baku Na2S2O3 0,1067 N, larutan baku I2 0,0960 N, Vit C, dan tissue. B. Cara kerja 1. Penetapan kadar Vit C secara Iodimetri Disiapkan alat dan bahan yang akan digunakan. Ditimbang 600 mg sampel Vit C lalu dilarutkan dalam air bebas CO2 sebanyak 10 mL kemudian ditambahkan 5 ml H2SO4 2 M setelah itu dititrasi dengan larutan I2 0,0060 dengan menggunakan indicator kanji hingga terjadi perubahan warna dari bening menjadi biru mantap. Selanjutnya dihitung kadar Vit C. 2. Penetapan kadar CuSO4.5H2O secara Iodometri Disiapkan alat dan bahan yang akan digunakan. Ditimbang sampel CuSO4.5H2O 150 mg lalu dilarutkan dalam 25 mL aquadest kemudian ditambahkan 3 mL asam asetat. Setelah itu ditambahkan KI sebanyak 500 mg lalu dititrasi dengan larutan baku Na2S2O3 0,1067 N hingga berubah warna menjadi kuning pucat. Kemudian ditambahkan beberapa tetes indicator kanji lalu dititrasi lagi dengan Na2S2O3 hingga berubah warna menjadi biru tepat hilang. Selanjutnya dihitung kadar CuSO4.5H2O.
BAB IV HASIL PENGAMATAN A. Tabel pengamatan 1. Iodimetri Sampel Asam askorbat Berat sampel 0,6025 Vol. titran 10,5 Perubahan warna Kuning biru hitam
2. Iodometri Sampel CuSO4.5H2O + KI Berat sampel 0,1572 0,5031 Vol. titran 6 3 Perubahan warna Kuning pucat Biru tepat hilang
B. Perhitungan 1. Iodimetri Mg rek sampel Mg/BE Mg Mg rek larutan baku = V.N = V.N.BE = 10,5.0,1025.88 = 94,7 mg = 0,0947 g % kadar =
100%
100%
= = 15,717 %
2. Iodometri Mg rek sampel Mg/BE Mg Mg rek larutan baku = V.N = V. N. BE = 6.0,1067.249,68 = 159,84 mg = 0,1598 g
% kadar
= =
= 101,65 %
100%
C. Reaksi 1. Iodimetri + C2H5OH + 2HI
4-ethyl-2,3 dihydroxy-cyclopent-2-enone-4-etyhlcyclopentane 1,2,3 trione 2. Iodometri CuSO4.5H2O+2KI I2+2Na2S2O3 CuI+K2SO4+ I2 2NaI+Na2S4O6
+ nI2
Kompleks I2 CH2OH H
kanji ( biru )
+ Na2S2O3
+ 2NaI + Na2S4O6
BAB V PEMBAHASAN
Iodimetri merupakan cara analisis volumetrik untuk zat-zat reduktor, seperti natrium tiosulfat, arsenat dengan menggunakan larutan baku iodine yang secara langsung, tetapi dapat juga langsung dengan cara penambahan larutan baku iodine berlebihan, dan kelebihan larutan iodine dititrasi kembali dengan larutan baku tiosulfat. Sedangkan iodometri adalah cara analisa volumetric secara tidak langsung untuk zat-zat reduktor seperti garam besi (III), tembaga (II) dimana zat-zat oksidator ini direduksi lebif dahulu dengan KI, dan iodin yang dihasilkan dalam jumlah yang setara dititrasi kembali dengan larutan baku Na2S2O3. Dalam praktikum iodimetri, sampel yang ditentukan kadarnya adalah vitamin C dengan metode titrasi secara langsung dan CuSO4.5H2O dengan metode titrasi tidak langsung. Untuk memulai percobaan ini, mula-mla disiapkan terlebih dahulu alat-alat yang akan digunakan. Ditimbang sampel vitamin C sebanyak 600 mg kemudian dimasukkan ke dalam erlenmeyer dan dilarutkan dalam aquadest bebas CO2 sebanyak 25 mL. Aquadest disini diperoleh dari hasil didihkan lalu didinginkan. Penambahan air bebas ini bertujuan untuk menghilangkan CO2 yang terdapat di dalam air dalam bentuk asam karbonat yang bereaksi seperti asam-asam lain. Kemudian ditambahkan 5 mL H2SO4 2 M. Penambahan ini dimaksudkan untuk memberi suasana asam karena bias dilakukan dalam suasana basa. Iodin bereaksi dengan ion hidroksida yang mula-mula membentuk ion hipoidit. Yang kemudian membentuk ion iodat dan ion-ion ini mengoksidasi sebagian tiosulfat menjadi ion sulfat. Sehingga titik kesetaraannya tidak tepat lagi. Lalu ditambahkan beberapa tetes indicator kanji. Penambahan ini dimasudkan dimana Iodin akan bereaksi pada permukaan beta-amilosa dari kanji yang berwarna biru intensif. Kemudian dititrasi dengan larutan baku I2 0.1025 N dimana titik akhir titrasi ditandai dengan perubahan warna dari kuning kebiru hitam. Ketika titran I2 berlebih maka sampel Vit C akan
habis bereaksi, sehingga terbentuklah ikatan indikator kanji dengan I2 yang stabil sehingga dapat menyebebkan perubahan warna dari bening kebiru. Dalam praktikum Iodometri, sampel yang digunakan adalah CuSO4.5H2O . Langkah awal dalam percobaan ini yaitu ditimbang sebanyak 0,1572 g lalu dimasukkan ke dalam Erlenmeyer dan dilarutkan dengan asam asetat 2 mL, kemudian ditambahkan 2 mL KI 0,5031 g . Penambahan ini dengan maksud untuk membebaskan ion Iodida dari KI sehingga penambahan ini dapat bereaksi dengan asam sulfat yang dibebaskan dari cuprii sulfat. Selain itu juga penambahan asam asetat untuk yaitu untuk memberi suasana asam pada larutan tersebut. Selanjutnya pada sampel CuSO4.5H2O ini yang bersifat oksidator kuat akan direduksi dengan kalium iodida berlebihan. Setelah itu dititrasi dengan Na2S2O3 0,0987 N sampai larutan berwarna kuning pucat. Adapun penambahan indikator kanji harus menunggu sampai mendekati titik akhir titrasi, agar amilum tidak membungkus Iod dan menyebabkan sangat sukar lepas kembali. Hal ini akan berakibat warna biru sulit lenyap sehingga titik akhir tidak kelihatan tajam lagi. Setelah penambahan indikator kanji, lalu dititrasi kembali dengan larutan baku NaS2O3 sampai larutan menjadi bening. Adapun alasan dilakukan titrasi kembali, yakni : 1. Ketika I2 masih banyak, otomatis ketika penambahan langsung dengan indikator kanji maka akan menyebabkan ikatan yang terbentuk menjadi sukar untuk terlepas. 2. Dengan iod memberi sesuatu yang kompleks yang tak dapat larut dalam air, sehingga kanji tidak boleh ditambahkan terlalu dini dalam titrasi. Dari percobaan yang telah dilakukan, diperoleh %kadar asam askorbat sebesar 15,717 % dan CuSO.5H2O sebesar 101,65 %. Namun hasil tersebut tidak sesuai dengan literatur, dimana pada pustaka FI edisi III hal 47 menyatakan bahwa asam askorbat mengandung tidak kurang dari 99,0 % C 6H2O6. Sedangkan pada pustaka FI edisi III hal 731 menyatakan bahwa tembaga (II) sulfat mengandung tidak kurang dari 98,5 % dan tidak lebih dari 101,0 %.
Dalam percobaan ini redapat beberapa faktor kesalahan yakni, kurang tekanan yang diberikan terlalu besar, kurangnya ketelitian praktikan ketika sedang menitrasi. Adapun penggunaan metode Idimetri dan Iodometri dalam bidang farmasi salah satunya yaitu dalam menetapkan kadar dari zat-zat uji yang bersifat reduktor dan oksidator, seperti asam askorbat, metampiron (antalgin) serta natrium tiosulfat dan sediaan tabletnya.
BAB VI PENUTUP A. Kesimpulan Berdasarkan percobaan yang telah dilakukan, dapat disimpulkan dimana pada penetapan kadar Vit C yaitu 15,717 %, sedangkan pada literatur dari FI edisi III yaitu tidak kurang dari 99,0%. Untuk penetapan kadar tembaga (II) sulfat yaitu 101,65 %,sedangkan pada literature FI edisi III hal 731 tidak kurang dari 98,5 % dan tidak lebih dari 101,5 %. B. Saran 1. Untuk laboratorium Mohon dilengkapi alat dan bahannya 2. Untuk asisten Tolong keaktifannya dalam membimbing praktikan.
DAFTAR PUSTAKA Day, R. A. dan A. L. Underwood. . Analisis Kimia Kuantitatif. Erlangga:Jakarta.1981 Dirjen pom.Farmakope Indonesia Edisi III. Depkes RI : Jakarta.1979 Harjadi, W.. Ilmu Kimia Analitik Dasar. Erlangga: Jakarta.1993. Haeriah. Penuntun Praktikum Kimia Analisis. UIN Alauddin : Makassar.2011. Khopkar S. M. . Konsep Dasar Kimia Analitik. UI Press. Jakarta. 1990 Sudjaji. Kimia Farmasi Analisis . Pustaka pelajar : Yoyakarta.2007
SKEMA KERJA
1. Iodimetri Vit C 0,6025 g Larutkan dalam 20 mL H2O bebas CO2 + 3 mL H2SO4 10 % + Indikator kanji Titrasi dengan I2 Hit. Kadar Vit C 2. Iodometri CuSO4.5H2O 0,1572 g Larutkan dalam 20 mL H2O +2 mL CH3COOH +0,5031 g KI
Titrasi dengan Na2S2O3 + Indikator kanji
Titrasi dengan Na2S2O3 Hit. Kadar CuSO4.5H2
LAPORAN PRAKTIKUM KIMIA ANALISIS PERCOBAAN IODIMETRI-IODOMETRI
OLEH KELOMPOK GOLONGAN ASISTEN : I : II : YASSIR ARAFAT, S. Farm., Apt.
JURUSAN FARMASI FIKES UNIVERSITAS ISLAM NEGERI ALAUDDIN MAKASSAR SAMATA GOWA 2011
You might also like
- Jurnal Praktikum Titrasi Iodometri IodimetriDocument14 pagesJurnal Praktikum Titrasi Iodometri IodimetriHilyaa Hilya100% (2)
- OPTIMASI_ARGENTOMETRIDocument12 pagesOPTIMASI_ARGENTOMETRICarin Indhita40% (5)
- Titrasi Bromometri FixDocument23 pagesTitrasi Bromometri FixNesya0% (1)
- Makalah DDS Nasal & Pulmonary PDFDocument34 pagesMakalah DDS Nasal & Pulmonary PDFMustakim Masnur Al BiruniNo ratings yet
- Laporan Praktikum IodometriDocument28 pagesLaporan Praktikum IodometriAyu Melinda100% (1)
- Iodometri Dan Iodimetri: Bab 1 Pendahuluan 1.1 Latar BelakangDocument29 pagesIodometri Dan Iodimetri: Bab 1 Pendahuluan 1.1 Latar BelakangHilda KrisyantiNo ratings yet
- Laporan Iodometri IodometriDocument26 pagesLaporan Iodometri Iodometrimsiregar_38No ratings yet
- Laporan Praktikum Titasi IodometriDocument7 pagesLaporan Praktikum Titasi IodometriShofwah Ma'wah100% (2)
- Iodo IodimetriDocument24 pagesIodo IodimetriArifin I. Oputu100% (1)
- Laporan Praktikum KompleksometriDocument7 pagesLaporan Praktikum KompleksometriRisnawati FarmNo ratings yet
- Laporan Praktikum ArgentometriDocument25 pagesLaporan Praktikum ArgentometriNadiyah Salma AthayaNo ratings yet
- Titrasi IodimetriDocument7 pagesTitrasi IodimetriSitiMasitohHSEl-Nazwah65% (17)
- Titrasi IodometriDocument7 pagesTitrasi IodometriSitiMasitohHSEl-Nazwah100% (3)
- Laporan Praktikum Farmasi IodometriDocument11 pagesLaporan Praktikum Farmasi IodometriNovandi IsmailNo ratings yet
- Laporan Titrasi IodimetriDocument7 pagesLaporan Titrasi Iodimetrisepatu-keraton100% (1)
- Laporan Titrasi KompleksometriDocument14 pagesLaporan Titrasi KompleksometriDonny Iswadi57% (7)
- Bab II Dasar Teori IodometriDocument24 pagesBab II Dasar Teori IodometriNisa.estuuNo ratings yet
- Laporan NitrimetriDocument11 pagesLaporan Nitrimetrimawaddah_pratiwi100% (2)
- Jurnal IodometriDocument13 pagesJurnal IodometriyayukNo ratings yet
- Titrasi IodimetriDocument6 pagesTitrasi Iodimetrimashfufatul ilmaNo ratings yet
- Pembahasan Praktikum IodometriDocument5 pagesPembahasan Praktikum IodometriDelis Saniatil HayatNo ratings yet
- Laporan Titrasi Iodometri RevisiDocument32 pagesLaporan Titrasi Iodometri Revisisyaiful islamiNo ratings yet
- Laporan Akhir Titrasi KompleksometriDocument10 pagesLaporan Akhir Titrasi Kompleksometrianjanidinda0% (1)
- Laporan Praktikum IodometriDocument9 pagesLaporan Praktikum IodometriFatthonah Az'zahraNo ratings yet
- Pembahasan Titrasi IodimetriDocument5 pagesPembahasan Titrasi IodimetriDelis Saniatil HayatNo ratings yet
- IodometriDocument3 pagesIodometriChandra PambudiNo ratings yet
- IodometriDocument8 pagesIodometriDea NugrahaNo ratings yet
- KADAR PAPAVERINDocument29 pagesKADAR PAPAVERINHasriadi Al-Farabi80% (5)
- Iodimetri Vit CDocument14 pagesIodimetri Vit CMirza AhmadNo ratings yet
- Iodometri dan IodimetriDocument8 pagesIodometri dan IodimetriYehezkhiel Octora DeniNo ratings yet
- Titrasi IodometriDocument18 pagesTitrasi IodometriNovi WidiyantiNo ratings yet
- IODIMETRIDocument3 pagesIODIMETRIAllex Norland100% (2)
- Praktikum Iodometri-IodimetriDocument25 pagesPraktikum Iodometri-Iodimetriclaudia0% (1)
- Laporan Praktikum VolhardDocument6 pagesLaporan Praktikum VolhardShofwah Ma'wah100% (1)
- Pembahasan Titrasi IodimetriDocument16 pagesPembahasan Titrasi IodimetriUgih Srirahayu100% (1)
- Laporan PermanganometriDocument26 pagesLaporan PermanganometriAudry F. DewiNo ratings yet
- Dasar Teori Titrasi Kompleksometri NewDocument11 pagesDasar Teori Titrasi Kompleksometri NewRaven Moarte50% (2)
- IODOMETRIDocument6 pagesIODOMETRIAyu Marisa Al-RahmanNo ratings yet
- Laporan Praktikum BromometriDocument6 pagesLaporan Praktikum BromometriAhmad Tafaqquh Fiddiin100% (3)
- Analisis AirDocument14 pagesAnalisis AirLintang Ayupertiwi100% (1)
- Laporan Kiman - IodometriDocument17 pagesLaporan Kiman - Iodometriastri dianiNo ratings yet
- Pengertian IodimetriDocument1 pagePengertian IodimetriOkta WahyunaNo ratings yet
- Laporan Lengkap IodometriDocument15 pagesLaporan Lengkap Iodometrieva indriyani0% (1)
- Laporan Iodometri Dan BromometriDocument14 pagesLaporan Iodometri Dan BromometriKhiky TahirNo ratings yet
- Titrasi Iodimetri (1112016200038)Document6 pagesTitrasi Iodimetri (1112016200038)Christopher HermanNo ratings yet
- Kiman BromatometriDocument14 pagesKiman Bromatometrianggie oktavianiNo ratings yet
- Laporan Praktikum ArgentometriDocument14 pagesLaporan Praktikum ArgentometriAyu Melinda100% (1)
- KADAR_CuSO4Document6 pagesKADAR_CuSO4SukmaSuci100% (2)
- UNTUK BAB I PENDAHULUAN TITRASI PERMANGANOMETRIDocument31 pagesUNTUK BAB I PENDAHULUAN TITRASI PERMANGANOMETRICrindle CandyNo ratings yet
- ANALISIS TITRIMENTRIDocument19 pagesANALISIS TITRIMENTRIGledys Tham PutiNo ratings yet
- Laporan Iodometri Iodometri PDFDocument26 pagesLaporan Iodometri Iodometri PDFAchmad16No ratings yet
- Iodo Iodi MetriDocument20 pagesIodo Iodi MetriHurufMatiNo ratings yet
- IODIMETRI DAN IODOMETRIDocument17 pagesIODIMETRI DAN IODOMETRIsteven gunardiNo ratings yet
- IODOMETRIDocument16 pagesIODOMETRIIndah Sari UtamiNo ratings yet
- IodometriDocument13 pagesIodometriDamin AlamNo ratings yet
- Dasar Teori IdiometriDocument6 pagesDasar Teori IdiometriGraha Ditha Pratilajathi SiswamarganaNo ratings yet
- Laporan Akhir-Novia Risky Nur-1801029-IODIMETRIDocument15 pagesLaporan Akhir-Novia Risky Nur-1801029-IODIMETRINovia risky nurNo ratings yet
- Rosdiana Putri - Titrasi Iodo Dan IodiDocument20 pagesRosdiana Putri - Titrasi Iodo Dan IodiHanduk BasahNo ratings yet
- Laporan 7 Iodometri & IodimetriDocument19 pagesLaporan 7 Iodometri & IodimetriAyu Lestari SuhartoNo ratings yet
- Iodo Dan BromoDocument14 pagesIodo Dan BromoRafika Firda Umamy HatibieNo ratings yet
- Kasus 4 LihinjiDocument5 pagesKasus 4 LihinjiMustakim Masnur Al BiruniNo ratings yet
- Catatan Riwayat PenyakitDocument9 pagesCatatan Riwayat PenyakitMustakim Masnur Al BiruniNo ratings yet
- Daftar Kasus Yang Telah Didapatkan MPPDDocument3 pagesDaftar Kasus Yang Telah Didapatkan MPPDMustakim Masnur Al BiruniNo ratings yet
- Rotasi MPPD Di RS JejaringDocument9 pagesRotasi MPPD Di RS JejaringMustakim Masnur Al BiruniNo ratings yet
- Absen MPPDDocument1 pageAbsen MPPDMustakim Masnur Al BiruniNo ratings yet
- Kasus 4 EdwardDocument5 pagesKasus 4 EdwardMustakim Masnur Al BiruniNo ratings yet
- Penyebab Luka Yang Paling Mungkin (CODamage)Document1 pagePenyebab Luka Yang Paling Mungkin (CODamage)Mustakim Masnur Al BiruniNo ratings yet
- Petunjuk Pelaksanaan Kepaniteraan Klinik Dept IpdDocument14 pagesPetunjuk Pelaksanaan Kepaniteraan Klinik Dept IpdMustakim Masnur Al BiruniNo ratings yet
- KoledokolitiasisDocument6 pagesKoledokolitiasisMustakim Masnur Al BiruniNo ratings yet
- Pedoman Tesis 2017Document48 pagesPedoman Tesis 2017dim393No ratings yet
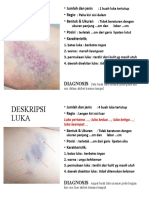
- DESKRIPSI LUKA Punya Lihin JiDocument2 pagesDESKRIPSI LUKA Punya Lihin JiMustakim Masnur Al BiruniNo ratings yet
- Tugas Farfis Bu MimiekDocument7 pagesTugas Farfis Bu MimiekMustakim Masnur Al BiruniNo ratings yet
- Laporan Praktikum GCMSDocument7 pagesLaporan Praktikum GCMSMustakim Masnur Al BiruniNo ratings yet
- Laporan Praktikum HPLCDocument6 pagesLaporan Praktikum HPLCMustakim Masnur Al BiruniNo ratings yet
- OlehDocument27 pagesOlehEka RahayuNo ratings yet
- PERKADES TENTANG PENGELOLAAN PASAR DESA - Website Desa NgumbulDocument1 pagePERKADES TENTANG PENGELOLAAN PASAR DESA - Website Desa NgumbulMustakim Masnur Al BiruniNo ratings yet
- Contoh Surat LamaranDocument1 pageContoh Surat Lamarananon_66823386No ratings yet
- Abdul Roni-Keamanan (Safety) Penggunaan Obat TradisionalDocument8 pagesAbdul Roni-Keamanan (Safety) Penggunaan Obat TradisionalMustakim Masnur Al BiruniNo ratings yet
- Borang Untuk ResertifikasiDocument28 pagesBorang Untuk ResertifikasiNober Sandy LayukNo ratings yet
- Laporan Praktikum HPLCDocument7 pagesLaporan Praktikum HPLCMustakim Masnur Al BiruniNo ratings yet
- Laporan Praktikum GCMSDocument8 pagesLaporan Praktikum GCMSMustakim Masnur Al BiruniNo ratings yet
- Baku InternalDocument3 pagesBaku InternalMustakim Masnur Al BiruniNo ratings yet
- Managing Operations - Mat ManagemenDocument46 pagesManaging Operations - Mat ManagemenMustakim Masnur Al BiruniNo ratings yet
- Vaksin DnaDocument16 pagesVaksin DnaMustakim Masnur Al BiruniNo ratings yet
- Mustakim Masnur-Bioaktif Tanaman ObatDocument19 pagesMustakim Masnur-Bioaktif Tanaman ObatMustakim Masnur Al BiruniNo ratings yet
- Classifying Inhibitor Kinase Likeness by SVM, ANN, K-NN, & DTDocument6 pagesClassifying Inhibitor Kinase Likeness by SVM, ANN, K-NN, & DTMustakim Masnur Al BiruniNo ratings yet
- Rancangan Formula Parenteral Injeksi VIAL Na Diklofenak PDFDocument27 pagesRancangan Formula Parenteral Injeksi VIAL Na Diklofenak PDFMustakim Masnur Al Biruni100% (1)
- Planar KromatografiDocument25 pagesPlanar KromatografiMustakim Masnur Al BiruniNo ratings yet
- Uji Pra KlinikDocument14 pagesUji Pra KlinikGendis WijayaNo ratings yet