Professional Documents
Culture Documents
Makalah Kimia Gas Mulia
Uploaded by
Dimas TriyonoOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Makalah Kimia Gas Mulia
Uploaded by
Dimas TriyonoCopyright:
Available Formats
Gas Mulia Karya Ilmiah Diajukan untuk memenuhi salah satu tugas pelajaran kimia kelas xi semester 3 oleh
Aditya Parlindungan. Josua Gregory Silaen. Rho natta Mentari Matahari. Ronal Tjahyadi. XI IPA B Sekolah Menengah Atas Negeri 78 Jl. Bhakti IV/I Komp. Pajak Kemanggisan JAKARTA BARAT Telp. 021-5327115, Fax. 021-5482914 KATA PENGANTAR. Puji dan syukur kami ucapkan ke hadirat Tuhan YME karena atas rahmat dankaruniaN ya kami dapat menyelesaikan karya ilmiah tentang gas mulia ini. Penulisan
karya ilmiah tentang gas mulia ini betujuan tidak lain adalah untuk memenuhi tug askimia kelas xi semester 3 tentang kimia unsur. Selain itu, karya ilmiah ini ju ga dibuatuntuk meningkatkan rasa ingin tahu pembaca dan masyarakat mengenai gasgas golongan 8A yang jarang ditemui dan langka. Kesulitan yang penulis hadapi dalam membuat karya ilmiah ini adalah kurangnya sumber informasi dalam bahasa Indonesia mengingat gas mulia merupakan suatu hal yang langka, dan koordinasi tim yang kurang menjadi penghambat dalam penulisan kaya tulis ini. Namun, kesalahan adanya memang dimanu sia dan kesempurnaan adanya di tangan Tuhan. Ucapan terima kasih kami ucapkan ke segenap kalangan yang telah membantukami dal am penulisan karya tulis ini. Jasa-jasa kalian tak akan terlupakan seumurhidup. Penulis juga menerima segala kritik dan saran atas penulisan karya ilmiah ini, mengingat segala keterbatasan dan kekurangan yang penulis miliki. Jakarta, 12 November 2008 Tim Penulis 1. Gas Mulia. Gas mulia adalah grup elemen kimia dengan sifat-sifat yangsama: di kondisi stand ar, they semua tidak berbau, tidak berwarna, dan monoatomik dengan reaktivitas yang sangat rendah. Merekaditempatkan di grup 18 (8A) dari tebel periodike (sebelumnya dikenal dengan grup 0). 6 gas mulia tersebut terdapat di alam dengan bentuk helium (He), neon (Ne), argon (Ar), krypton (Kr),
xenon (Xe), dan radon yang bersifat radioaktif (Rn). sejauh ini, 3 atom dari gru pselanjutnya, ununoctium (Uuo) telah berhasil disintesis di supercollider, tapi sangatsedikit yang diketahui mengenai elemen ini karena jumlah yang dihasilkan s angatsedikit dan memiliki waktu paruh hidup yang sangat pendek . Sifat-sifat gas mulia bisa dijelaskan dengan baik dengan teori modern tentangstr uktur atom: valensi elektron kulit luar mereka dianggap "penuh", memberi mereka sedikit sekali kesempatan untuk berpartisipasi dalam reaksi kimia, danhan ya beberapa ratus senyawa yang telah disiapkan. Titik didih dan titik leleh gasm ulia mempunyai nilai yang dekat, berbeda kurang dari 10 C (18 F); yangmengakibatka n mereka berbentuk cairan dalam jangkauan suhu yang pendek. Neon, argon, krypton, dan xenon are didapatkan dari udara mengunakanmetode menca irkan/mengembunkan gas dan penyulingan bagian. Helium biasanyaterpisah dari gas alami, dan radon biasanya diisolasi dari penguraian radioaktif darielemen radium yang terurai. Gas mulia mempunyai beberapa aplikasi penting diindustri seperti penerangan, pengelasan, dan perjalanan angkasa luar. Gas prnapasan Helium-oksigen biasanya digunakan oleh penyelam laut dalam yangbiasany a lebih dari 180 kaki (55 m) untuk menjaga penyelam dari oksigen toxemia, efek berbahaya dari oksigen dalam tekanan tinggi, dan nitrogen narcosis, efeknar kotik yang membingungkan dari nitrogen di udara melebihi tekanan biasa. Afterset elah bahaya yang ditimbulkan hidrogen atas mudah meledaknya elemen tersebut, gas tersebut diganti dengan helium. Sejarah. Gas mulia diterjemahkan dari kata benda Jerman Edelgas, pertama kali digunakan pada 1898 oleh Hugo Erdmann untuk menunjukkan reaktivitas merekayang s angat rendah. Nam aitu membuat analogi dengan "logam mulia", sepertiemas, yang d iasosiasikan dengan kekayaan dan kebangsawanan, dan mempunyaireaktivitas yang re ndah. Gas mulia juga dinamkan gas inert, tapi label ini sekarangjarang digunakan karena sekarang banyak senyawa % composition of noble gases 1 0.5 0 gas mulia yang diketahui . Gas langka jugamerupakan nama yang digunakan, tapi in i jugalsotidak akurat karena argon membentuk bagian yang lumayan besar (0.94% dari segi volume, 1.3% dari segi massa) dari atmosfer bumi. Argon Neon Helium Krypton 1.Komposisi gas mulia di atmosfer 2. Helium Helium (He) adalah unsur kimia yang tak berwarna, tak berbau, tak berasa, tak beracun, hampir inert, monatomik, dan merupakan unsur pertama pada seri gas
mulia dalam tabel periodik dan memiliki nomor atom 2. Titik didih dan titik lebu rnyamerupakan yang terendah dari unsur-unsur lain dan ia hanya ada dalam bentuk gaskecuali dalam kondisi "ekstrem". Kondisi ekstrem juga diperlukan untuk menciptakan sedikit senyawa helium, yang semuanya tidak stabil pada suhu danteka nan standar. Helium memiliki isotop stabil kedua yang langka yang disebut helium-3. Sifat dari cairan varitas helium-4; helium I dan helium II; penting ba gipara periset yang mempelajari mekanika kuantum (khususnya dalam fenomenasuperf luiditas) dan bagi mereka yang mencari efek mendekati suhu nol absolutyang dimil iki benda (seperti superkonduktivitas). 1. Gas helium Helium adalah unsur kedua terbanyak dan teringandi jagad raya dan salah satu uns ur yang siciptakanpada saat nukleosintesis Big Bang. Dalam Jagad Raya modern hampir seluruh helium baru diciptakan dalam proses fusi nuklir hidrogen di dalam bintang. Di Bumi, unsur ini diciptakan oleh peluruhan radioaktif dari unsur yang lebih berat (partikel alfa adalah nukleus helium). Setelah penciptaannya, sebagian darinya terkandung di udara (gas alami) dalam konsentrasi sampai 7% volume. Helium dimurnikan dari udara oleh proses pemisahan suhu rendah yang disebut distilasi fraksional. Pada 1868, astronom Prancis Pierre Janssen mendeteksi pertama kali helium sebagai signatur garis spektral kuning yang tak diketahui dari cahaya dari gerhana matahari. Sejak itu kandungan helium besar banyak ditemukan di ladang gas alam di Amerika Serikat, yang merupakan penyedia gas terbesar. Helium digunakan ; * Sebagai gas mulia tameng untuk mengelas * Sebagai gas pelindung dalam menumbuhkan kristal-kristal silikon dan germanium dan dalam memproduksi titanium dan zirkonium. * Sebagai agen pendinginuntuk reaktor nuklir. * Sebagai gas yang digunakan di lorong angin (wind tunnels). Campuran helium dan oksigen digunakan sebagai udara buatan untuk para penyelam dan para pekerja lainnya yang bekerja di bawah tekanan udara tinggi. Perbandingan antara He dan O2 yang berbeda-beda
digunakan untuk kedalaman penyelam yang berbeda-beda. Helium sangat banyak digunakan untuk mengisi balon ketimbang hidrogen yanglebih berbahaya. Salah satu kegunaan helium yang lain adalah untuk menekan
bahan bakar cair roket. Roket Saturn, seperti yang digunakan pada misi-misi Apol lo, memerlukan sekitar 13 juta kaki kubik He. Helium cair yang digunakan di Magnetic Resonance Imaging (MRI) tetapbertambah ju mlahnya, sejalan dengan ditemukannya banyak kegunaan mesin ini dibidang kesehata n. Helium juga digunakan untuk balon-balon raksasa yang memasang berbagaiiklan peru sahaan-perusahaan besar, termasuk Goodyear. Aplikasi lainnya sedangdikembangkan oleh militer AS adalah untuk mendeteksi peluru-peluru misil yangterbang rendah. Badan Antariksa AS NASA juga menggunakan balon-balon berisi gas helium untuk mengambil sampel atmosfer di Antartika untuk menyelidiki penyebab menipisnya lapisan ozon. Menghirup sejumlah kecil gas ini akan menyebabkan perubahan sementara kualitas suara seseorang. Harga 1 kaki kubik helium jatuh dari US $2.500 di tahun 1915 menjadi 1.5 sen dit ahun 1940. Biro Pertambangan AS telah mematok harga Grade A helium sebesar$37,50 per 1000 kaki kubik di tahun 1986. Helium memiliki titik lebur paling rendah di antara unsur-unsur dan banyakdiguna kan dalam riset suhu rendah (cyrogenic) karena titik leburnya dekat dengan0 dera jat Kelvin. Juga, unsur ini sangat vital untuk penelitian superkonduktor. Dengan menggunakan helium cair, Kurti dkk. beserta yang lainnya telah berhasilme ncapai suhu beberapa mikrokelvin dengan proses adiabatic demagnitizationnukleus tembaga. Helium memiliki sifat-sifat unik lainnya, yaitu sebagai satu-satunya benda cairy ang tidak bisa diubah bentuknya menjadi benda padat hanya dengan menurunkansuhu. Unsur ini tetap dalam bentuknya yang cair sampai 0 derajat Kelvin padatekanan n ormal, tetapi akan segera berbentuk padat jika tekanan udara dinaikkan. 3He dan 4He dalam bentuk padat sangat menarik karena keduanya dapat berubahvolum e sampai 30% dengan cara memberikan tekanan udara. Specifikasi panas helium sangat tinggi. Berat jenis gas helium pada titik didihn ormal juga sangat tinggi. Molekul-molekul gasnya mengembang dengan cepatketika d ipanaskan ke suhu ruangan. Sebuah bejana yang diisi dengan gas heliumpada 5 dan 10 Kelvin harus diperlakukan seakan-akan berisikan helium cair karenaperubahan t ekanan yang tinggi yang berasal dari pemanasan gas ke suhu ruangan. Secara normal, helium memiliki 0 valensi, tapi ia juga memiliki tendensi untukme nggabungkan diri dengan unsur-unsur lainnya. Cara membuat helium difluoridatelah dipelajari dan senyawa HeNe dan ion-ion He+ dan He+ + juga telah diteliti. Ada 7 isotop helium yang diketahui: helium cair (He-4) yang muncul dalam duabent uk: He-4I dan He-4II dengan titik transisi pada 2.174K. He-4I (di atas suhu ini) adalah cair, tetapi He-4II (di bawah suhu tersebut) sangat berbeda dari bahanbah an kimia lainnya. Helium mengembang ketika didinginkan, konduktivitaskalornya sanga t tinggi, dan konduksi panas atau viskositasnya tidak menurutiperaturan-peratura n biasanya. . Keterangan umum Helium Nama, Lambang, Nomor atom : helium, He, 2 Deret kimia : gas mulia Golongan, Periode, Blok : 18, 1, s Penampilan : tak berwarna
Massa atom : 4,002602(2) g/mol
Konfigurasi elektron : 1s2 Jumlah elektron tiap kulit : 2 Fase : gas Massa jenis : (0 C; 101,325 kPa) 0,1786 g/L Titik lebur : (pada 2,5 MPa) 0,95 K(-272,2 C, -458,0 F) Titik didih : 4,22 K (-268,93 C, -452,07 F) Kalor peleburan : 0,0138 kJ/mol Kalor penguapan : 0,0829 kJ/mol Kapasitas kalor : (25 C) 20,786 J/ (molK) Tekanan uapP/Pa : 1 10 100 1 k 10 k 100 kpada T/K 3 4 Struktur kristal : heksagonal atau bcc Energi ionisasi : pertama: 2372,3 kJ/mo ke-2: 5250,5 kJ/mol
Jari-jari atom (terhitung) : 31 pm Jari-jari kovalen : 32 pm Jari-jari Van der Waals : 140 pm Konduktivitas termal : (300 K) 151,3 mW/(mK) Isotop : iso NA waktu paruh DM DE (MeV) DP : 3He 0,000137%* He stabil dengan 1 neutron 4He 99,999863%* He stabil dengan 2 neutron Pemanfaatan Helium-3 Jika suatu saat manusia benar-benar berhasil membangun koloni di Bulan, 2.contoh rencana sumber energi adalah salah satu masalah yangpengambilan helium3 di bulan harus terpenuhi. Para ilmuwan dari badanantariksa berbagai negara ten gah menyiapkanbahan bakar yang diambil dari bahan galian diperut Bulan. Bahan ba kar yang dimaksudadalah helium-3, salah satu isotop unsur gas. Helium-3 secara teori dapat dipakai sebagaibahan baku pembangkit listrik tenaga nuklir. Proses konversi menjadi listrik bahkan lebihramah lingkungan daripada reaktor nu klir diBumi karena hanya menghasilkan sedikitlimbah. Penggunaan Helium-3 berbeda dengan Uranium. Pembangkit listrik tenaganuklir yang menggunakan uranium dilakukan melalui reaksi fisi, di mana inti atomdibelah-bel ah menjadi lebih kecil untuk melepaskan energi. Sementara Helium-3
dapat dipakai alam reaksi fusi di mana, inti atom-atomnya yang bertabrakanmemben tuk inti atom baru lebih besar dan melepaskan energi. "Ia merupakan sumber energi yang lebih bersih dan aman daripada bahanbakar nukli r," ujar Gerald Kulcinski, direktur Institut Teknolog Fusion di UniversitasWinco nsin, Madison, AS. Sekitar 40 ton Helium-3 cukup untuk memasok kebutuhanenergi d i seluruh AS selama setahun. Helium-3 sangat jarang ditemukan di Bumi namun banyak terkandung dalamtanah Bula n. Sejumlah negara yang telah memulai program eksplorasi Bulanseperti China, Rus ia, dan India menjadikan Helium-3 sebagai target sumber energimasa depan untuk p rogram ruang angkasanya. Namun, membangun reaktor fusi lebih sulit daripada reaksi fisi karenamenbutuhkan energi awal yang sangat besar. Belum ada satu pun reaktor fusi yangberoperasi d i Bumi. Baru satu prototip yang tengah dibangun, yakni fasilitas yangdiberi nama ITER (International Thermonuclear Experimental Reactor) diCadarache, Perancis. Reaktor percobaan tersebut baru akan beroperasi mulai 2016dan mulai menghasilkan energi 20 tahun kemudian. bahan baku yang digunakan disana bukan Helium-3 melai nkan deuterium dan tritium. 3. Neon Neon adalah suatu unsur kimia dalam tabel periodik yangmemiliki lambang Ne danno mor atom 10. Neon termasuk kelompok gasmulia yang tak berwarna danlembam (inert). Zat inimemberikan pendar khaskemerahan jika digunakan di tabung hampa (vacuum discharge tube) dan lampuneon. Sifat ini memb uat neon terutama dipergunakan sebagai bahan pembuatanlampu-lampu dan tanda ikla n. . Keterangan Umum Neon Nama, Lambang, Nomor atom : neon, Ne, 10 Deret kimia : gas mulia Golongan, Periode, Blok : 18, 2, p Penampilan : takberwarna Massa atom : 20.1797(6) g/mol Konfigurasi elektron : 1s2 2s2 2p6 Jumlah elektron tiap kulit : 2, 8 Fase : gas Massa jenis : (0 C; 101,325 kPa) 0.9002 g/L Titik lebur : 24.56 K (-248.59 C, -415.46 F) Titik didih : 27.07 K (-246.08 C, -410.94 F) Titik tripel : 24.5561[1] K, 43 kPa[2] Titik kritis : 44.4 K, 2.76 MPa Kalor peleburan : 0.335 kJ/mol Kalor penguapan : 1.71 kJ/mol
Kapasitas kalor Tekanan uapP/Pa 18 Struktur kristal Bilangan oksidasi Energi ionisasi(detil) Jari-jari atom (terhitung) Jari-jari kovalen Jari-jari Van der Waals Sifat magnetik Konduktivitas termal Kecepatan suara Nomor CAS Isotop 4. Argon : (25 C) 20.786 J/(molK) : 1 10 100 1 k 10 k 100 k pada T/K 12 13 15 21 27 : kubus pusat badan : tak ada data : ke-1: 2080.7 kJ/molke-2: 3952.3 kJ/molke-3: 6122 kJ/mol : : : : : : : 38 pm 69 pm 154 pm nirmagnetik (300 K) 49.1 mW/(mK) (gas, 0 C) 435 m/s 7440-01-9
: 20Ne 90.48% Ne stabil dengan 10 neutron21Ne 0.27% Ne stabil dengan 11 neutron 22Ne 9.25% Ne stabil dengan 12 neutron
Argon adalah unsur kimia dalam tabel periodik yang memiliki simbol Ar dannomor a tom 18. Asal nama Argon adalah yang malas, tidak aktif, diambil daribahasa yunan i yang juga merupakan ciri-ciri dari argon yang susah untuk beraksi. Gas mulia ke-3, di periode 8, membentuk 1% dari atmosfer bumi. Gas mulia argon ini memiliki kelarutan dalam air yang samadengan gas oksigen, dan 2,5 kali lebih larutdibanding gas nitrogen. Argon digunakan untukberbagai macam hal, seperti t eknik pemotretan. 3.1 argon beku yang mengembun Metode Cavendish untuk mengisolasi Argon. Gas-gas diletakkan di test-tube (A) yangdiberdirikan di atas alkali lemah dalam jumlah yangbesar (B), dan arus dialirkan di kawat diisolasi olehtube kaca yang b erbentuk U (CC) yang melewaticairan dan memutari mulut dari test-tube. Ujung dariPlatinum dalam (DD) darikabel itu mendapat arusdari ba tere dari lima sel Grove dan gulunganRuhmkorff berukuran sedang. Argon juga digunakanuntuk pemadam api
khusus untuk menghindari kerusakan peralatan. Argon digunakan karenaargon merupa kan salah satu gas mulia yang paling murah. . Keterangan Umum Argon : : : : : : : : : : : Nama, Lambang, Nomor atom Deret kimia Golongan, Periode, Blok Penampilan Massa atom Konfigurasi elektron Jumlah elektron tiap kulit argon, Ar, 18 gas mulia 18, 3, p tak berwarna 39,948(1) g/mol [Ne] 3s2 3p6 2, 8, 8 gas (0 C; 101,325 kPa) 1,784 g/L 83,80 K (-189,35 C, -308,83 F) 87,30 K (-185,85 C, -302,53 F)
: 1,18 kJ/mol : 6,43 kJ/mol : 25 C) 20,786 J/(molK) : 1 10 100 1 k 10 k 100 k 47 53 61 71 87 : kubus pusat muka : 0 : tak tersedia (skala Pauling) : pertama 1520,6 kJ/mol ke-2: 2665,8 kJ/mol ke-3: 3931 kJ/mol : 71 pm : : : : : 71 pm 97 pm 188 pm nonmagnetik (300 K) 17,72 mW/(mK)
: (gas, 27 C) 323 m/s waktu paruh DM DE (MeV) DP Fase Massa jenis Titik lebur Titik didih Kalor peleburan Kalor penguapan Kapasitas kalor
Tekanan uapP/Pa pada T/K Struktur kristal Bilangan oksidasi Elektronegativitas Energi ionisasi Jari-jari atom Jari-jari atom (terhitung) Jari-jari kovalen Jari-jari Van der Waals Sifat magnetik Konduktivitas termal Kecepatan suara Isotop iso NA data
36Ar 37Ar 38Ar 39Ar 40Ar 42Ar
0,337% Ar stabil dengan 18 neutron syn 35 hari e ? 37Cl 0,063% Ar stabil dengan 20 neutron syn 269 tahun -0,56539K 99,600% Ar stabil dengan 22 neutron syn 32,9 tahun -0,60042K
5. Krypton Kripton adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Krda n nomor atom 36. Kripton , seperti gas mulia lainnya, dapat digunakan difotograf i. Cahaya kripton mempunyai banyak garis-garis spektral, satuan resmi meter di dapat dari panjabng satu garis spektral jingga-merahdari kripton-86. Kripton juga merupakan salah satu produk dari pembelahan uranium. Kripton ditemukan oleh Sir William Ramsay dan Morris Travers di residu yang tersisa dari penguapan hampir semua komponen di udara. William Ramsay dihadiahi nobel kimia pada 1904 untuk penemuan beberapa gas mulia, termasuk kripton. Konsentrasi kripton di atmosfer bumi yaitu sekitar 1 ppm. Ia dapat diekstrak dari udara cair melalui penyulingan sebagian. 4.Sir William Ramsay Kripton berguna dalam flash pemotretan berkecepatan tinggi. Gas kripton jugadicampurkan dengan gas lain untuk membuat plang bersinar yang berwarna hijau kekuningan . Kripton dicampur dengan Argon sebagai gas pengisi lampu fluorescent hemat energi. Ini menggurangi tegangan dan daya yang dipakai.. Sayangnya, ini juga mengurangi terangnya lampu dan menambah harganya. Harga kripton 100 kali harga argon. Kripton mempunyai peran pentind dalam membuat dan penggunaan laser kripton florida. Laser ini penting dalam penelitian energi fusi nuklir di eksperiman perbatasan. Laser itu memiliki keseragaman sinar yang tinggi,
panjang gelombang yang pendek. sinar laser Kripton juga seringdigunakan di lampu disko dan pengobatan mata. . Keterangan Umum Unsur Nama, Lambang, Nomor atom : krypton, Kr, 36 Deret kimia : gas mulia Golongan, Periode, Blok : 18, 4, p Penampilan : tak berwarna Massa atom : 8(2) g/mol Konfigurasi elektron : [Ar] 3d10 4s2 4p6 Jumlah elektron tiap kulit : 2, 8, 18, 8 Fase : gas
Massa jenis : (0 C; 101,325 kPa) 3.749 g/L Titik lebur : 115.79 K (-157.36 C, -251.25 F) Titik didih : 119.93 K (-153.22 C, -243.8 F) Titik kritis : 209.41 K, 5.50 MPa Kalor peleburan : 1.64 kJ/mol Kalor penguapan : 9.08 kJ/mol Kapasitas kalor : (25 C) 20.786 J/(molK) Tekanan uapP/Pa : 1 10 100 1 k 10 k 100 k pada T/K 59 65 74 84 99 120 Struktur kristal : cubic face centered Bilangan oksidasi : 2 Elektronegativitas : 3.00 (skala Pauling) Energi ionisasi (detil) : ke-1: 1350.8 kJ/mol: ke-2: 2350.4 kJ/mol: ke-3: 3565 k J/mol Jari-jari atom (terhitung) : 88 pm Jari-jari kovalen : 110 pm Jari-jari Van der Waals : 202 pm Sifat magnetik : nonmagnetic Konduktivitas termal : (300 K) 9.43 mW/(mK) Kecepatan suara : (gas, 23 C) 220 m/s Kecepatan suara : (liquid) 1120 m/s Nomor CAS : 7439-90-9 Isotop iso NA waktu paruh DM DE (MeV) DP 78Kr 0.35% 2.31020 ye e 78Se 79Kr syn 35.04 h e 79Br + 0.604 79Br . 0.26, 0.39, 80Kr 2.25% Kr stabil dengan 44 neutron 81Kr syn 2.29105 ye 81Br . 0.28182Kr 11.6% Kr stabil dengan 46 neutron 83Kr 11.5% Kr stabil dengan 47 neutron 84Kr 57% Kr stabil dengan 48 neutron 85Kr syn 10.756 y -0.68785Rb 86Kr 17.3% Kr stabil dengan 50 neutron 6. Xenon
Xenon adalah unsur dengan lambang kimia Xe, nomor atom 54 dan massa atom relatif 131,29; berupa gas mulia, tak berwarna, tak berbau dan tidak ada rasanya. Xenon diperoleh dari udara yang dicairkan. Xenon dipergunakan untuk mengisi lampu sorot, dan lampu berintensitas tinggi lainnya, mengisi bilik gelembung yang dipergunakan oleh ahli fisika untuk mempelajari 5.Gas Xenon 12
partikel sub-atom. Xenon digunakan di alat penghasil cahaya yangdisebut xenon fl ash lamps, yang digunakan di lampu sorot fotografidan lampu stroboscopic untuk m engeksitasi medium yang aktif dilaser which yang kemudian menghasilkan cahaya ko heren. dandigunakan juga di lampu bakterisidal. 6.Xenon Xenon juga diketahui merupakan gas hexafluoroplatinate mulia pertama yang berhasil dibuat senyawanya, yaitu Xe[PtF6] atau Xenon hexafluoroplatinate. Laser berkedudukan pertama, ditemukan pada 1960 dipompa oleh lampu flash xenon, dan laser digunakan untuk menyalakan batas
inerti fusi juga dipompa oleh lampu sorotxenon. Xenon juga digunakan untukfotogr afi bawah laut Lampu lengkungxenon untuk fotografi bawah lautmenghasilkan sinar dengan intesitaskonstan 5,600 a.u. (1 a.u.=10-8 cm.). Dengan Kamera 16mm yang ta han airdipasang di ujung depan torpedo. tren yang paling signifikan adalah desai n 8.Xenon dan keadaan peralatan spesial ini untuk para amatir . Lampu lengkungxenon juga t erbukti dapat mencegah kebutaan dari diabetis retinopati. Prosesnyaadalah mengha ncurkan pembuluh darah di mata yang telah membuat perdarahan divitreous dan seir ing waktu, pembuluh darah baru akan menggantikannya. 7. Lampu lengkung Xenon . Keterangan umum Xenon Name, symbol, number Element category Group, period, block Appearance Standard atomic weight Electron configuration Electrons per shell Phase Density Melting point -169.1 F) Boiling point
-162.62 F) Triple point Critical point Heat of fusion Heat of vaporization Specific heat capacity Vapor pressureP/Pa at T/K Crystal structure : xenon, Xe, 54 : noble gases : 18, 5, p : colorless gas : 131.293(6) gmol-1 : [Kr] 5s2 4d10 5p6 : 2, 8, 18, 18, 8 : gas : (0 C, 101.325 kPa) 5.894 g/L : (101.325 kPa) 161.4 K (-111.7 C, : (101.325 kPa) 165.03 K (-108.12 C, : 161.405 K (-112C), 81.6[1] kPa : 289.77 K, 5.841 MPa : (101.325 kPa) 2.27 kJmol-1 : (101.325 kPa) 12.64 kJmol-1 : (100 kPa, 25 C) 20.786 Jmol-1K-1 : 1 10 100 1 k 10 k 100 k 83 92 103 117 137 165 : cubic face centered
Oxidation states Electronegativity Ionization energies Atomic radius (calc.) Covalent radius Van der Waals radius Magnetic ordering Thermal conductivity Speed of sound (liquid) CAS registry number Isotopes of xenon : 0, +1, +2, +4, +6, +8 (rarely more than 0) (weakly acidic oxide) : 2.6 (Pauling scale) : 1st: 1170.4 kJmol-1 2nd: 2046.4 kJmol-1 3rd: 3099.4 kJmol-1 : 108 pm : 130 pm : 216 pm : : : : nonmagnetic (300 K) 5.65x10-3 Wm-1K-1 1090 m/s 7440-63-3
: iso NA 124Xe neutrons 125Xe 126Xe neutrons 127Xe 128Xe neutrons 129Xe neutrons 130Xe neutrons 131Xe neutrons 132Xe neutrons 133Xe 134Xe neutrons 135Xe 136Xe neutrons
7. Radon half-life DM DE (MeV) DP 0.095% 124Xe is stable with 70 syn 16.9 h e 1.652125I 0.089% 126Xe is stable with 72 syn 36.345 d e 1.91% 128Xe is 26.4% 129Xe is 4.07% 130Xe is 21.2% 131Xe is 0.662127I stable with stable with stable with stable with 74 75 76 77
26.9% 132Xe is stable with 78 syn 5.247 d - 0.427133Cs 10.4% 134Xe is stable with 80 syn 9.14 h - 1.16 135Cs 8.86% 136Xe is stable with 82 Radon adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Rndan nomor atom 86. Radon juga termasuk dalam kelompok gas mulia danberadioaktif. Rad on terbentuk dari penguraian radium. Radon juga gas yang palingberat dan berbaha ya bagi kesehatan. Rn-222 mempunyai waktu paruh 3,8 hari dandigunakan dalam radi oterapi. Radon dapat menyebabkankanker paru paru, dan bertanggung jawab atas 20. 000kematian di Uni Eropa setiap tahunnya. Radon tidak mudah bereaksi secara kimia, tetapiberadioaktif, radon juga adalah g as alami (senyawa gasterberat adalah tungsten heksaflorida, WF6). Pada suhu dan 9.jalan masuk gas radon ke rumah 14
tekanan ruang, radon tidak berwarna tetapi apabila didinginkan hingga membeku, radon akan berwarna kuning, sedang kan radon cair berwarna merah jingga. Penumpukan gas Radon secara alamiah di atsmosfir bumi terjadi amat perlahansehin gga air yang menyentuh udara bebas terus kehilangan Radon karena proses Volatilisa si. Air bawah tanah mempunyai kandungan Radon lebih tinggi di bandingkanair perm ukaan.
Radon kadang digunakan oleh beberapa rumah sakit untuk kegunaanterapeutik. Radon tersebut di peroleh dengan pemompaan dari sumber Radium dandisimpan daloam tabu ng kecil yang disebut benih atau jarum . Radon sudahjarang di gunakan lagi namun, me at rumah sakit sekarang bisa mendapatkanbenih dari supplier yang menghasilkan benih dengan tingkat peluruhan yangdikehendaki. biasanya digunakan kobalt dan caesium yang tahan selama beberapatahun, sehingga lebih praktis ditinjau dari segi logis tik. Karena peluruhannya yang cukup depat. radon juga digunakan dalam penyelidikanhid rologi yang mengkaji interaksi antara air bawah tanah, anak sungai dan sungai. Peningkatan radon dalam anak sungai atau sungai merupakan petunjuk pentingbahwa terdapat sumber air bawah tanah Nama radon berasal dari radium. Radon ditemukan pada tahun 1900 olehFriedrich Er nst Dorn, yang menggelarnya sebagai pancaran radium. Pada tahun 1908William Rams ay dan Robert Whytlaw-Gray, yang menamakannya niton (dari bahasalatin nitens ber arrti "yang berkilauan"; simbol Nt), mengisolasinya, menenentukankepadatannya da n mereka menemukan bahwa Radon adalah gas paling berat padamasa itu (dan sampai sekarang). Semenjak 1923 unsur 87 ini disebut Radon. Rata rata, terdapat satu molekul radon dalam 1 x 1021 molekul udara. Radondapat di temukan di beberapa mata air dan mata air panas. Kota Misasa, Jepang, terkenal karena mata airnya yang kaya dengan radium yang menghasilkan radon. Radon dibebaskan dari tanah secara alamiah, apalagi di kawasan bertanah diGranit . Radon juga mungkin dapat berkumpul di ruang bawah tanah dan tempattinggal (Nam un ini juga bergantung bagaimana rumah itu di rawat dan ventilasinya) Uni Eropa mennentukan bahwa batas aman kandungan radon adalah 400 Bq/ EnvironmentalProtectio [[meter]3 untuk rumah lama, dan 200 Bq/m3 untuk rumah baru. n Agency Amerika mennyarankan untuk melakukan tindakan segera bagisemua rumah deng an kepekatan Radon melebihi 148 Bq/m3 (diukur sebagai4 pCi/L). Hampir satu rumah setiap 15 di A.S. mempunyai kadar radon yang tinggi menurutsta tistik (U.S. Surgeon General) dan EPA mencadangkan agar semua rumah diuji bagira don. Sejak 1985 di Amerika, jutaan rumah telah diuji kandungan radonnya. Pengujian menunjukkan bahwa flor dapat bereaksi dengan radon danmembentuk senyaw a radon florida. Senyawa radon klathrat juga pernah di temukan. Diketahui ada dua puluh Isotop radon yang diketahui. Yang paling stabil adalahRn -222 yang merupakan produk sampingan dari peluruhan radium-236, Rn-222mempunyai waktu parah 3,823 hari (330.307,2 detik) dan memancarkan partikelalpha. Rn-220 a dalah produk sampingan dari peluruhan thorium dan disebut thoron. Waktu paruhnya 55.6 dan juga memancarkan sinar Alfa. Radon-219 diturunkan dariac tinium. Radon adalah gas karsinogen. Radon adalah bahan beradioaktif dan harusditangai s ecara hati-hati. Adalah sangat berbahaya untuk menghirup unsur ini karenaRadon m enghasilkan partikel alpha.
Radon juga menghasilkan hasil peluruhan berbentuk padat, dan akibatnya, cenderung membentuk debu halus yang mudahmemasuki jalur udara dan melekat perman en dalamjaringan paru-paru, menghasilkan paparan lokal yangparah. Ruang di mana radium, aktinium, atau thoriumdisimpan perlu diangin-anginkan dengan baik agarti dak terakumulasi dalam udara. Akumulasi radon berpontensi mengancam kesehatan dalam tambanguranium dan timah hitam. Pengumpula n radon dalamrumah juga merupakan suatu penemuan yang cukupbaru dan kebanyakan p enyakit kanker paru-parudikaitkan dengan pengumpulan radon setiap tahun. Radon dalam rumah dianggarkan menyebabkan kematian akibat kanker paru-paru sekitar 21,000 orang setiap tahun di U.S. Radon adalah penyebab utama kanker paru-paru di U.S. hari ini. . Keterangan Umum Unsur Nama, Lambang, Nomor atom Deret kimia Golongan, Periode, Penampilan Massa atom Konfigurasi elektron Jumlah elektron tiap kulit Fase Titik lebur Titik didih Kalor peleburan Kalor penguapan Kapasitas kalor Tekanan uapP/Pa pada T/K Struktur kristal Bilangan oksidasi Elektronegativitas data Energi ionisasi Jari-jari atom (terhitung) Jari-jari kovalen Sifat magnetik Konduktivitas termal : radon, Rn, 86 : gas mulia : Blok 18, 6, p : tak berwarna : (222) g/mol : [Xe] 4f14 5d10 6s2 6p6 : 2, 8, 18, 32, 18, 8 : gas : 202 K (-71 C, -96 F) : 211,3 K (-61,7 C, -79,1 F)
: 3,247 kJ/mol : 18,10 kJ/mol : (25 C) 20,786 J/(molK) : 1 10 100 1 k 10 k 100 k : 110 121 134 152 176 211 : kubus pusat muka : 0 : tidak tersedia (skala Pauling) : pertama: 1037 kJ/mol : 120 pm : 145 pm : nonmagnetik : (300 K) 3,61 mW/(mK)
17
You might also like
- 8349 11222 1 PB PDFDocument4 pages8349 11222 1 PB PDFKhoirotul RohmainahNo ratings yet
- SANWACANADocument3 pagesSANWACANADimas TriyonoNo ratings yet
- 8349 11222 1 PBDocument8 pages8349 11222 1 PBDimas TriyonoNo ratings yet
- Picking Data Gelombang Pada Seisgrm2k51 PDFDocument4 pagesPicking Data Gelombang Pada Seisgrm2k51 PDFDimas TriyonoNo ratings yet
- Seismik ProcessingDocument1 pageSeismik ProcessingDimas TriyonoNo ratings yet
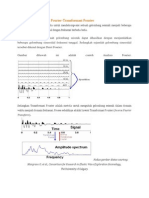
- Analisis FourierDocument4 pagesAnalisis FourierVebriyanti HayotoNo ratings yet
- MatahariDocument1 pageMatahariDimas TriyonoNo ratings yet
- Surat Keterangan Lunas 3802706046Document1 pageSurat Keterangan Lunas 3802706046Dimas TriyonoNo ratings yet
- AmplopDocument1 pageAmplopDimas TriyonoNo ratings yet
- Seismik ProcessingDocument1 pageSeismik ProcessingDimas TriyonoNo ratings yet
- COVERDocument1 pageCOVERDimas TriyonoNo ratings yet
- DekonvolusiDocument2 pagesDekonvolusiDimas TriyonoNo ratings yet
- Lamar Anker JaDocument1 pageLamar Anker JaDimas TriyonoNo ratings yet
- Surat PernyataanDocument1 pageSurat PernyataanDimas TriyonoNo ratings yet
- Perhitngan NmoDocument1 pagePerhitngan NmoDimas TriyonoNo ratings yet
- TDUET7RDocument1 pageTDUET7RDimas TriyonoNo ratings yet
- Tugas Praktikum GPRDocument2 pagesTugas Praktikum GPRDimas TriyonoNo ratings yet
- Perhitngan NmoDocument1 pagePerhitngan NmoDimas TriyonoNo ratings yet
- Kartu NamaDocument1 pageKartu NamaDimas TriyonoNo ratings yet
- Dimas Triyono - Uas Mitigasi BencanaDocument3 pagesDimas Triyono - Uas Mitigasi BencanaDimas TriyonoNo ratings yet
- AkustikDocument3 pagesAkustikDimas TriyonoNo ratings yet
- Pengolahan Data Seismik MarineDocument1 pagePengolahan Data Seismik MarineDimas TriyonoNo ratings yet
- Paper EM FixDocument5 pagesPaper EM FixDimas TriyonoNo ratings yet
- Cover UnilaDocument1 pageCover UnilaDimas TriyonoNo ratings yet
- Abs TrakDocument1 pageAbs TrakDimas TriyonoNo ratings yet
- Sistem Informasi GeografisDocument2 pagesSistem Informasi GeografisDimas TriyonoNo ratings yet
- Permohonan PembimbingDocument2 pagesPermohonan PembimbingDimas TriyonoNo ratings yet
- Bindo 1Document1 pageBindo 1Dimas TriyonoNo ratings yet
- Cover KimiaDocument2 pagesCover KimiaDimas TriyonoNo ratings yet
- StratigrafiDocument5 pagesStratigrafiDimas TriyonoNo ratings yet