Professional Documents
Culture Documents
Katalis
Uploaded by
Putri RizkyOriginal Description:
Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Katalis
Uploaded by
Putri RizkyCopyright:
Available Formats
Apa itu KATALIS?
Menurut definisi, katalis adalah suatu senyawa kimia yang dapat mengarahkan sekaligus meningkatkan kinetika suatu reaksi (jika reaksi tersebut secara termodinamika memungkinkan terjadi). Namun senyawa tersebut (katalis) tidak mengalami perubahan kimiawi diakhir reaksi, dan tidak mengubah kedudukan kesetimbangan kimia dari reaksi. Mengapa katalis sangat penting dalam proses kimia? Pentingnya katalis ditunjukkan oleh kenyataan bahwa lebih dari 75% proses produksi bahan kimia di industri disintesis dengan bantuan katalis. Contoh proses kimia yang sangat penting misalnya sintesis metanol dari syngas (CO dan H2) dikatalisis oleh ZnO/Cr2O3, dan reaksi water gas shift (WGS), CO + 2H2O == CO2 + H2 dikatalisis oleh besi oksida atau oksida campuran Zn, Cu maupun Cr. Teknologi katalis telah digunakan dalam industri kimia lebih dari 100 tahun lamanya dan penelitian serta pengembangan teknologi katalis telah menjadi semacam bidang kekhususan kimia. Jadi, apa yang dikerjakan oleh katalis dalam sebuah reaksi? Dalam kazanah energi reaksi, katalis menurunkan rintangan energi atau menurunkan besaran energi aktifasi sebuah reaksi melalui aneka mekanisme fisikawi maupun kimiawi. Komponen inti katalis menurut derajat kepentingannya: 1. Selektifitas Adalah kemampuan katalis untuk memberikan produk reaksi yang diinginkan (dalam jumlah tinggi) dari sekian banyak produk yang mungkin dihasilkan. Produk yang diinginkan tadi sering disebut sebagai yield sedangkan banyaknya bahan baku yang berhasil diubah menjadi aneka produk dikatakan sebagai konversi. Yield = %selektifitas x konversi 2. Stabilitas Kemampuan sebuah katalis untuk menjaga aktifitas, produktifitas dan selektifitasnya dalam jangka waktu tertentu 3. Aktifitas Kemampuan katalis untuk mengubah bahan baku menjadi produk atau aneka produk yang diinginkan (lebih dari satu). Aktifitas = massa (kg) bahan baku yang terkonversi/(kg atau liter katalis x waktu) atau Konversi, yaitu persentase dari bahan baku menjadi aneka produk.
atau TON (turnover Number), yaitu banyaknya molekul yang bereaksi/(waktu, misalnya detik x setiap situs aktif) Apakah tiga metode untuk mengukur aktifitas katalis? 1. Aktifitas dapat dinyatakan dalam konsep kinetika. Aktifitas dapat dinyatakan dari pengukuran kecepatan reaksi dalam jangkauan tertentu suhu dan konsentrasi. Kecepatan reaksi, r, dihitung sebagai kecepatan perubahan sejumlah zat, nA dari reaktan A persatuan waktu dan per satuan volume (atau per satuan massa) katalis, sehingga r ini memiliki unit mol L-1 h-1 atau mol kg-1 h-1. 2. Aktifitas dapat pula dinyatakan oleh turnover number (TON) yang didefinisikan sebagai banyaknya molekul reaktan yang terlibat dalam reaksi tiap situs aktif dan tiap detik. 3. Dalam prakteknya, sebagai perbandingan aktifitas, ukuran-ukuran berikut ini dapat pula digunakan: a. Konversi dalam kondisi reaksi tetap b. Space velocity untuk konversi tetap yang tertentu c. Space-time yield d. Suhu yang dibutuhkan untuk suatu konversi tertentu Pengelompokan katalis Perlu diingat bahwa yang dimaksud katalis homogen artinya adalah katalis yang memiliki atau bisa membentuk satu fasa dengan reaktan dan pelarutnya (misal fasa cair-cair pada sistem katalis asam untuk reaksi esterifikasi). Sedangkan katalis heterogen tidak memiliki fasa yang sama dengan reaktan maupun pelarut (misalnya fasa padat-cair pada sistem katalis zeolit untuk perengkahan hidrokarbon). Katalis adalah suatu zat yang dapat mempercepat laju reaksi. Katalis dapat mempercepat laju reaksi dengan cara memilih tahap reaksi yang memiliki energi aktivasi yang lebih rendah sehingga kompleks teraktivasi lebih mudah terbentuk dan reaksi menjadi lebih cepat. Dengan kata lain penambahan katalis memberikan jalan baru bagi reaksi yang memiliki energi aktivasi yang lebih rendah, sehingga lebih banyak molekul yang bertumbukan pada suhu normal dan laju reaksi semakin cepat. Dengan adanya terowongan, kendaraan dapat sampai ke seberang tanpa harus mendaki melewati puncak bukit sehingga perjalanan lebih cepat dan lebih mudah. Analog dengan terowongan, suatu katalis dapat memberikan sebuah jalur baru yang lebih mudah bagi jalannya reaksi. Meskipun jalur baru tersbut tidak benar-benar datar, namun setidaknya lebih landai daripada melalui energi aktivasi semula. Katalis dapat berfungsi sebagai zat perantara bagi zat-zat pereaksi dan sebagai zat pengikat. Katalis sebagai zat perantara yang pada hasil akhir reaksi diperoleh kembali. Sebagai contoh yakni reaksi sebagai berikut : Reaksi tanpa katalis : A + B ---> AB (lambat)
Reaksi dengan katalis(k): A + B ---> AB (cepat) mekanisme reaksinya yaitu : B + K ---> BK BK + A ---> A-B-K A-B-K ---> A-B + K Dengan terikatnya zat B pada katalis, maka senyawa B-K yang terbentuk menjadi lebih reaktif ketika bereaksi dengan A hingga terbentuk senyawa AB-K. Pada tahap berikutnya dihasilkan senyawa AB dan katalis K diperoleh kembali ke dalam jumlah yang sama seperti semula. Katalis yang biasa digunakan yakni katalis NO yang digunakan pada reaksi pembentukan gas SO3. Sedangkan contoh katalis sebagai zat pengikat yakni katalis logam seperti nikel (Ni), platina (Pt), dan kromium (Cr). Permukaan logam-logam tersebut memiliki kemampuan mengikat zat yang akan beraksi sehingga terbentuk spesi yang reaktif. Dan pernahkah anda mendengar biokatalis?? Biokatalis merupakan katalis yang berperan untuk mengkatalisis reaksi yang berlangsung di dalam tubuh makhluk hidup. Senyawa yang termasuk biokatalis adalah enzim. Enzim memiliki mekanisme kerja yang sangat spesifik, yaitu satu enzim hanya bekerja untuk mengkatalisis satu macam reaksi. Sebagai contoh, enzim amilase hanya bekerja pada penguraian amilum dan tidak dapat bekerja pada proses reaksi lain.
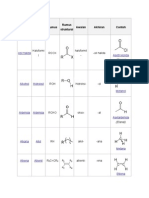
Tipe katalis Katalis homogen Katalis homoheterogen Katalis heterogen
Katalis asam/basa Kompleks logam transisi
Biokatalis (enzim) Fungsional nanopartikel
Bulk katalis (alloy logam) Katalis yang diemban
Perbandingan elemen katalis homogen dan heterogen Elemen Katalis Efektifitas Pusat aktif Konsentrasi dibutuhkan Selektifitas Masalah difusi Homogen Heterogen
Semua atom yangHanya atom-atom pada memiliki reaktifitas permukaan partikel yangRendah Tinggi
Tinggi Lebih rendah Secara praktis tak adaAda (perpindahan massa (kinetika mempengaruhi jalannya mengendalikan reaksi) jalannya reaksi) Kondisi reaksi Lembut (50 200 oC)Parah (sering > 250 oC) Penggunaan Tertentu/spesifik Luas Potensi kehilanganBereaksi kembaliKristal logam aktifitas dengan produkmengalami sintering, (pembentukan keracunan, coking, klaster) danfouling, migrasi uap keracunan metal pada suhu tinggi Sifat katalis Struktur/stoikiometri Mudah ditentukan Sulit ditentukan Kemungkinan Tinggi Rendah modifikasi Daya tahan suhu Rendah Tinggi Tehnik pemisahanSeringkali rumitSuspensi, filtrasi (sistem katalis (distilasi, ekstraksi,slurry) dekomposisi kimiawi) Tidak perlu pemisahan (sistem fixed-bed) Kemungkinan daurBisa dilakukan Tidak perlu (fixed-bed) ulang katalis Mudah (suspensi atau slurry) Potensi kehilanganTinggi Rendah katalis
Katalis Salah satu cara lain untuk mempercepat laju reaksi adalah dengan jalan
menurunkan energi pengaktifan suatu reaksi. Hal ini dapat dilakukan dengan menggunakan katalis.Katalis adalah zat yang dapat meningkatkan laju reaksi tanpa dirinya mengalami perubahan kimia secara permanen. Katalis dapat bekerja dengan membentuk senyawa antara atau mengabsorpsi zat yang direaksikan. Suatu reaksi yang menggunakan katalis disebut reaksi katalis dan prosesnya disebut katalisme. Katalis suatu reaksi biasanya dituliskan di atas tanda panah, misalnya. 2 KClO3 (g) -MnO 2 KCl (s) + 3 O 2 (g) H2 (g) + Cl2 (g) arang 2 HCl (g) Secara umum proses sustu reaksi kimia dengan penambahan katalis dapat dijelaskan sebagai berikut. Perhatikan zat A dan zat B yang direaksikan membentuk zat AB dengan zat C sebagai katalis. AB (reaksi lambat) A + B Bila tanpa katalis diperlukan energi pengaktifan yang tinggi dan terbentuknya AB lambat. AC Namun, dengan adanya katalis C, maka terjadilah reaksi: A + C (reaksi cepat). Energi pengaktifan diturunkan, AC terbentuk cepat dan seketika itu juga AC bereaksi dengan B membentuk senyawa ABC. ABC (reaksi cepat) AC + B Energi pengaktifan reaksi ini rendah sehingga dengan cepat terbentuk ABC yang kemudian mengurai menjadi AB dan C. AB + C (reaksi cepat) ABC Energi pengaktifan reaksi zat A dan zat B tanpa dan dengan katalis ditunjukkan dalam Katalis menyebabkan energi pengaktifan reaksi lebih rendah Ada dua macam katalis, yaitu katalis positif (katalisator) yang berfungsi mempercepat reaksi, dan katalis negatif (inhibitor) yang berfungsi memperlambat laju reaksi. Katalis positif berperan menurunkan energi pengaktifan, dan membuat orientasi molekul sesuai untuk terjadinya tumbukan.
You might also like
- Apakah Katalis Dapat DibedakanDocument11 pagesApakah Katalis Dapat DibedakanMMarwantoNo ratings yet
- Raka Affa, Xi Ipa 7, 26Document3 pagesRaka Affa, Xi Ipa 7, 26Raka Affa100% (1)
- Sifat KatalisDocument4 pagesSifat Katalisna__adhieNo ratings yet
- PDF Materi Kuliah Katalis - CompressDocument31 pagesPDF Materi Kuliah Katalis - CompressTDPK Adit dan HarisNo ratings yet
- Katalis dalam Reaksi KimiaDocument9 pagesKatalis dalam Reaksi KimiaDelviaNo ratings yet
- Katalis Adalah Zat Yang Ditambahkan Ke Dalam Suatu Reaksi Dengan Maksud Memperbesar Kecepatan ReaksiDocument9 pagesKatalis Adalah Zat Yang Ditambahkan Ke Dalam Suatu Reaksi Dengan Maksud Memperbesar Kecepatan ReaksiAiri Cryosurgery WrounglerNo ratings yet
- Dasar Katalis & KatalisisDocument11 pagesDasar Katalis & KatalisisFebrian Adhitya RachmanNo ratings yet
- Materi Kuliah KatalisDocument31 pagesMateri Kuliah KatalisHakamNo ratings yet
- 09 Handout Dasar2 Katalis KatalisisDocument11 pages09 Handout Dasar2 Katalis KatalisisNdut Luph MbemNo ratings yet
- Faktor - Faktor Yang Mempengaruhi Laju ReaksiDocument5 pagesFaktor - Faktor Yang Mempengaruhi Laju ReaksiHarisma Nugraha100% (4)
- Kinetika Kimia 5Document16 pagesKinetika Kimia 5novaratu384No ratings yet
- KATALISISDocument11 pagesKATALISISAndreas Sahat P. SinagaNo ratings yet
- KATALIS KIMIADocument20 pagesKATALIS KIMIAFirman AjiNo ratings yet
- Sejarah Dan Perkembangan KatalisDocument27 pagesSejarah Dan Perkembangan KatalisAnnita Karunia Savitri100% (2)
- TRK KatalisDocument20 pagesTRK KatalisAnggi Yudi TiawarmanNo ratings yet
- DPPTDocument30 pagesDPPTDianIswariNo ratings yet
- Materi Laju ReaksiDocument9 pagesMateri Laju ReaksiMĕĭsűt ŌudzilNo ratings yet
- Definisi Katalis PDFDocument6 pagesDefinisi Katalis PDFDiansyah_AR100% (1)
- KATALIS MAKALAHDocument20 pagesKATALIS MAKALAHOnggy Aries SekaNo ratings yet
- Energi Aktivasi Dan KatalisDocument9 pagesEnergi Aktivasi Dan KatalisNur FitrianiNo ratings yet
- KatalisDocument27 pagesKatalisDhea NiidiyaNo ratings yet
- Nia Adharianti 1507123682 s1c Uas KatalisDocument21 pagesNia Adharianti 1507123682 s1c Uas KatalisNia Adha RyantieNo ratings yet
- Sifat Fisik KatalisDocument19 pagesSifat Fisik KatalisAstri HandayaniNo ratings yet
- Fungsi KatalisDocument3 pagesFungsi KatalisTika FNo ratings yet
- KINETIKA KIMIADocument11 pagesKINETIKA KIMIAarsitadevyNo ratings yet
- Efek KatalisDocument2 pagesEfek KatalisTri Heny LestariNo ratings yet
- Laju Reaksi (Pengaruh Katalis Terhadap Laju ReaksiDocument8 pagesLaju Reaksi (Pengaruh Katalis Terhadap Laju ReaksiGp ÀrièsNo ratings yet
- Komponen Dalam KatalisDocument35 pagesKomponen Dalam KatalisDaniiSimanjuntakNo ratings yet
- Katalis MempercepatDocument3 pagesKatalis MempercepatDony PuteraSriwijayaNo ratings yet
- KatalisDocument6 pagesKatalisNadia NovitaNo ratings yet
- Mekanisme Reaksi KatalisDocument31 pagesMekanisme Reaksi KatalisI'm GrooteNo ratings yet
- Makalah Kimia KatalisDocument28 pagesMakalah Kimia KatalisfebrinaNo ratings yet
- Tugas KatalisDocument5 pagesTugas KatalisTina LianaNo ratings yet
- Katalis KimiaDocument10 pagesKatalis KimiaChairun NisaNo ratings yet
- KatalisKimiaDocument27 pagesKatalisKimiaSa'adah0% (1)
- Makalah Kimia Katalis PDFDocument28 pagesMakalah Kimia Katalis PDFWindi7No ratings yet
- Katalis EtnaRufiati 10880Document2 pagesKatalis EtnaRufiati 10880Viva ViskrivasNo ratings yet
- Tugas Katalis 1Document5 pagesTugas Katalis 1Susi AmooreaNo ratings yet
- Semua Materi KatalisDocument32 pagesSemua Materi KatalisAnnita Karunia SavitriNo ratings yet
- Kimia Fisika 3 Katalis Belum FixxDocument15 pagesKimia Fisika 3 Katalis Belum FixxSariNo ratings yet
- Fixed Bed Dan Fluidized Bed ReaktorDocument56 pagesFixed Bed Dan Fluidized Bed ReaktorArdifal JumaidiNo ratings yet
- REAKSI FASE CAIRDocument12 pagesREAKSI FASE CAIRNadiratul KhairahNo ratings yet
- Faktor Laju ReaksiDocument6 pagesFaktor Laju ReaksiCHakun 1999No ratings yet
- 3 Ringkasan Katalis Dan KatalisisDocument7 pages3 Ringkasan Katalis Dan KatalisisGenzo WakabayashiNo ratings yet
- MEKANISME REAKSI KATALISDocument33 pagesMEKANISME REAKSI KATALISLafi FlafianaNo ratings yet
- Katalis, Kimia Fisika, Physical ChemistryDocument7 pagesKatalis, Kimia Fisika, Physical ChemistryRetno PrasetiaNo ratings yet
- KD II Kinetika KimiaDocument39 pagesKD II Kinetika KimiaHumaira FaradillaNo ratings yet
- Katalis HomogenDocument7 pagesKatalis HomogenKiki Mulqiah100% (1)
- Katalis HomogenDocument14 pagesKatalis HomogenAbdul AzisNo ratings yet
- Katalis Dalam IndustriDocument8 pagesKatalis Dalam IndustriChintiya AsmaraniNo ratings yet
- Faktor Yang Memengaruhi Laju ReaksiDocument16 pagesFaktor Yang Memengaruhi Laju ReaksiKaunaini ChusnaNo ratings yet
- REAKSI FASE CAIRDocument8 pagesREAKSI FASE CAIRNadiratul KhairahNo ratings yet
- Laju ReaksiDocument42 pagesLaju ReaksiKemal Yusron100% (1)
- Kimia KatalisDocument73 pagesKimia KatalisArtanti SekariniNo ratings yet
- Bab 1Document5 pagesBab 1Putri RizkyNo ratings yet
- BENTONIT SEBAGAI NANOFILLERDocument31 pagesBENTONIT SEBAGAI NANOFILLERPutri RizkyNo ratings yet
- 11735095Document6 pages11735095Putri RizkyNo ratings yet
- Pengaruh Ukuran Benih Terhadap Perkecambahan Dan Pertumbuhan Bibit Tanjung (Mimusops Elengi L.)Document6 pagesPengaruh Ukuran Benih Terhadap Perkecambahan Dan Pertumbuhan Bibit Tanjung (Mimusops Elengi L.)rikyfirdausNo ratings yet
- Kelas KimiawiDocument7 pagesKelas KimiawiPutri RizkyNo ratings yet
- Polimerisasi Adisi Yaitu Penambahan Unit Monomer Yang Terus Menerus Dipacu Oleh Suatu IntermedietDocument5 pagesPolimerisasi Adisi Yaitu Penambahan Unit Monomer Yang Terus Menerus Dipacu Oleh Suatu IntermedietPutri RizkyNo ratings yet
- 33 96 2 PBDocument6 pages33 96 2 PBPutri RizkyNo ratings yet
- SssDocument54 pagesSssHildayanti MustikasariNo ratings yet
- SssDocument54 pagesSssHildayanti MustikasariNo ratings yet
- Jadwal Penyusunan Laporan Kegiatan TPLDocument1 pageJadwal Penyusunan Laporan Kegiatan TPLPutri RizkyNo ratings yet
- AkrilatDocument6 pagesAkrilatPutri RizkyNo ratings yet
- BahanDocument33 pagesBahanPutri RizkyNo ratings yet
- HIDRAT DidDocument1 pageHIDRAT DidPutri RizkyNo ratings yet
- Pak HariDocument16 pagesPak HariPutri RizkyNo ratings yet
- Prinsip Spektroskopi MassaDocument2 pagesPrinsip Spektroskopi MassaPutri RizkyNo ratings yet
- Pembuatan TempeDocument4 pagesPembuatan TempePutri RizkyNo ratings yet
- Aas 1Document6 pagesAas 1Asih Mahmudah100% (1)
- TANIN PROPERTIDocument5 pagesTANIN PROPERTIRahmdita357No ratings yet
- Surat Kuasa. Ary.Document1 pageSurat Kuasa. Ary.Putri RizkyNo ratings yet
- AKRILATDocument2 pagesAKRILATPutri RizkyNo ratings yet
- AKRILATDocument2 pagesAKRILATPutri RizkyNo ratings yet
- Tug AsDocument7 pagesTug AsPutri RizkyNo ratings yet
- PUSIIIIIIIIIIIIIIIIIIIIIINGGGGGGGGDocument10 pagesPUSIIIIIIIIIIIIIIIIIIIIIINGGGGGGGGPutri RizkyNo ratings yet
- KatalisDocument5 pagesKatalisPutri RizkyNo ratings yet