Professional Documents
Culture Documents
Perbedaan klorofil A dan B
Uploaded by
Chilfanny SumantiOriginal Description:
Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Perbedaan klorofil A dan B
Uploaded by
Chilfanny SumantiCopyright:
Available Formats
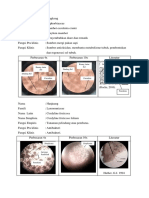
Perbedaan klorofil A dan klorofil B 1. Rumus kimia: klorofil a C55 H72 O5 N4 Mg dan klorofil b C55H70O6N4 Mg 2.
Gugus pengikat: Klorofil a CH3 Klorofil b CH 3. Cahaya yang diserap: Klorofil a menyerap cahaya biru-violet dan merah. Klorofil b menyerap cahaya biru dan oranye dan memantulkan cahaya kuning-hijau. 4. Absorpsi maksimum Klorofil a pada 673 nm Klorofil b pada 455-640 nm 5. Klorofil a paling banyak terdapat pada Fotosistem II Klorofil b paling banyak terdapat pada Fotosistem I literatur:
Stryer, L. 1995. Biokimia. Vol.2. E/4 Terj. Dari: Biochemistry 4/E. Oleh Sadikin, M & Zahir, S.S. dkk. Jakarta: Penerbit Buku Kedokteran EGC. Lakitan, B. 1993. Fisiologi Tumbuhan. Jakarta. Darmawan, J. & Baharsjah, J. 1983. Dasar-Dasar Ilmu Fisiologi Tanaman. Campbell, N.A., J.B. Recce, & L.G. Mitchell. 2003. Biologi. Edisi ke-5 Terj. Dari: Biology. 5th ed. Oleh Manalu, W. Jakarta. Penerbit Erlangga.
Pengetian senyawa organologam
Senyawa organologam adalah senyawa di mana atom-atom karbon dari gugus organik terikat kepada atom logam. Sebagai contoh, suatu aloksida seperti (C3H7O)4 Ti tidaklah dianggap sebagai suatu senyawa organologam karena gugus organiknya terikat pada Ti melalui oksigen, sedangkan C6H5Ti(OC3H7)3 adalah organologam, karena terdapat ikatan suatu logam pada karbon.
Kimia organologam logam transisi masih relatif baru. Walaupun kompleks etilena platina yang disebut dengan garam Zeise, K[PtCl3(C2H4)], tetrakarbonilnikel, Ni(CO)4, dan pentakarboniliron, Fe(CO)5, yang kini diklasifikasikan senyawa organologam, telah dipreparasi di abad ke-19, ikatan dan strukturnya waktu itu belum dikeahui. Riset W. Hieber dkk pada senyawa karbonil logam merupakan penanda penting di tahun 1930-an, tetapi hasil-hasil studi ini sangat terbatas karena analisis struktur yang belum berkembang pada waktu itu. Penemuan ferosen, Fe(C5H5)2, di tahun 1951 merupakan fenomena penting dalam kimia organologam. Modus ikatan yang sangat unik dalam senyawa ini menjadi sangat jelas terlihat dengan hasil analisis struktural kristal tunggal sinar-X, spektrum NMR, spektrum IR, dsb; dan merupakan titik awal perkembangan selanjutnya di bidang ini. Merupakan penemuan besar bahwa ferosen menunjukkan kestabilan termal yang tinggi walaupun ada anggapan umum ikatan logam transisi-karbon akan sangat tidak stabil. Namun dengan jelas ditunjukkan bahwa senyawa ini memiliki struktur berlapis dengan lima atom karbon gugus siklopentadienil terikat secara simultan pada atom besi. Walaupun berbagai modus ikatan ligan hidrokarbon akhirnya ditemukan satu demi satu, aplikasi industri senyawa organologam logam transisi meningkat dengan penemuan katalis polimerisasi olefin (katalis Ziegler), katalis hidrogenasi homogen (katalis Wilkinson), dan katalis sintetik asimetrik. Hadiah Nobel dianugerahkan pada Ziegler dan Natta (1963), E. O. Fischer, dan G. Wilkinson (1973) sebagai penghargaan atas pentingnya penemuan-penemuan ini. Berdasarkan definisi, dalam senyawa organologam,paling tidak ada satu ikatan logam-karbon, tetapi kompleks CN dan sebagainya biasanya dianggap bukan senyawa organologam. Senyawa logam karbonil merupakan senyawa organologam; dalam berbagai aspek ikatan, struktur dan reaksi, dan senyawa-senyawa ini merupakan sistem model yang baik untuk memahami esensi kimia organologam logam transisi. a Senyawa karbonil logam Senyawa karbonil logam yang terdiri atas logam dan ligan CO biasanya dipreparasi dengan reaksi langsung serbuk logam yang kereaktifannya tinggi dengan karbon monoksida, atau dengan reduksi garam logam ke valensi nol diikuti dengan reaksi dengan karbon monoksida tekanan tinggi. Namun,
tetrakarbonilnikel, ditemukan pertamakali di akhir abad 19, terbentuk dengan reaksi logam nikel dan karbon monoksida pada suhu kamar dan tekanan atmosfer. Preparasi senyawa karbonil logam yang lain, di pihak lain memerlukan suhu dan tekanan tinggi.
Senyawa karbonil logam mononuklir memiliki struktur koordinasi polihedral yang bersimetri tinggi. Kromium, molibdenum, dan tungsten heksakarbonil, M(CO)6, mempunyai struktur oktahedral reguler, penta-koordinat pentakarbonilbesi, Fe(CO)5, berstruktur segitiga bipiramid, dan tetrakarbonilnikel, Ni(CO)4, memiliki koordinasi tetrahedral reguler (Gambar 6.14). Atom karbon ligan karbonil berkoordinasi dengan logam, dan lingkungan CO berorientasi searah dengan sumbu logam-karbon. Karbonil logam binuklir Mn2(CO)10 memiliki ikatan Mn-Mn yang menghubungkan dua piramida bujur sangkar Mn(CO)5. Dalam Fe2(CO)9, dua sub satuan Fe(CO)3dijembatani tiga ligan CO, dan dalam Co2(CO)8, dua satuan Co(CO)3 digubungkan dengan tiga jembatan CO dan sebuah ikatan Co-Co. Ada sejumlah senyawa karbonil logam dengan ikatan logam-logam yang menghubungkan tiga atau lebih logam, dan CO terminal, -CO (jembatan di antara dua logam), dan -CO (jembatan yang menutupi tiga logam) berkoordinasi dengan kerangka logam (lihat bagian 6.3 (f)). Banyak karbonil kluster yang dibentuk dengan reaksi senyawa karbonil mononuklir dan karbonil binuklir. Senyawa karbonil logam khas dan sifatnya diberikan di Tabel 6.4.
Donasi balik Senyawa karbonil logam terdiri dari karbon monoksida yang terkoordinasi pada logam bervalensi nol. Untuk waktu yang lama, orang tidak dapat menjelaskan mengapa ikatan semacam itu mungkin terjadi, dan apalagi ikatannya stabil. Kepercayaan bahwa ikatan koordinasi normal dibentuk dengan donasi elektron dari ligan yang sangat basa kepada logam merupakan dasar teori koordinasi A. Werner. Karena kebasaan karbon monoksida sangat rendah ikatan logam-karbon biasanya tidak stabil, oleh karena itu penjeasan yang cocok untuk kestabilan senyawa karbonil logam perlu dicari. Bila bentuk dan simetri orbital d logam dan orbital (anti ikatan) CO untuk ikatan karbon-oksigen bond cocok untuk tumpang tindih, interaksi ikatan antara logam dan karbon diharapkan dapat dibentuk. Skema ikatannya ditunjukkan di Gambar 6.15 berdasarkan pandangan ini. Mekanisme elektron didonasikan ke orbital * karbon monoksida yang kosong dari orbital d logam disebut donasi balik. Karena akumulasi elektron yang terlalu banyak dalam logam yang berbilangan oksidasi rendah dihindari, donasi balik menghasilkan stabilisasi ikatan M-C.
Peningkatan dalam orde ikatan logam-karbon direfleksikan dalam peningkatan frekuensi ulur M-C dan penurunan frekuensi ulur C-O dalam spektrum vibrasinya. Spektrum IR sangat bermanfaat sebab frekuensi karbonil sangat mudah dideteksi. Penurunan bilangan oksidasi logam dengan aliran muatan negatif dari ligan yang terkoordinasi tercerminkan dalam penurunan frekuensi ulur C-O.
You might also like
- Makalah Respirasi Kelompok 1Document118 pagesMakalah Respirasi Kelompok 1Gian's KerenzNo ratings yet
- Perbedaan Klorofil a dan b dalam FotosintesisDocument1 pagePerbedaan Klorofil a dan b dalam FotosintesisWidia PitrianiNo ratings yet
- C. Hubungan Antara Biomassa Dan Produktivitas D.Document23 pagesC. Hubungan Antara Biomassa Dan Produktivitas D.ulla_ullaNo ratings yet
- Laporan Praktikum Bryophyta Pteridophyta SpermatophytaDocument21 pagesLaporan Praktikum Bryophyta Pteridophyta SpermatophytaAhmad Rafi Satrio Prayogo100% (1)
- KLH 8. Proses Fotosintesis Tanaman C3 Dan C4 (PersamaanDocument24 pagesKLH 8. Proses Fotosintesis Tanaman C3 Dan C4 (PersamaanfikriNo ratings yet
- 17 - Laila Dhiya Ulhaq - 190341621607 - Anatomi BatangDocument13 pages17 - Laila Dhiya Ulhaq - 190341621607 - Anatomi Batanglaila dhiyaNo ratings yet
- 5 Kepunahan Massal Terbesar Di BUMIDocument6 pages5 Kepunahan Massal Terbesar Di BUMIEka S. SaputraNo ratings yet
- Gerak Pada TumbuhanDocument27 pagesGerak Pada TumbuhanRinda ResutariNo ratings yet
- Bab IiDocument14 pagesBab Iimoecitra_3591564820% (1)
- Makalah FotosintesisDocument10 pagesMakalah FotosintesisAndang SyaifudinNo ratings yet
- Anatomi DaunDocument9 pagesAnatomi DaunBinti MusrifahNo ratings yet
- ACARA VII Pengukuran Parameter AprilDocument6 pagesACARA VII Pengukuran Parameter AprilArief33% (3)
- Fotoperiodisme: Pengertian, Mekanisme dan PeranannyaDocument4 pagesFotoperiodisme: Pengertian, Mekanisme dan PeranannyaSushi Ikan32No ratings yet
- Rekayasa Genetik Dalam Bidang PanganDocument24 pagesRekayasa Genetik Dalam Bidang PanganAfida Tul Hasanah100% (1)
- Jaringan pengangkut tumbuhanDocument3 pagesJaringan pengangkut tumbuhanelsasiregarNo ratings yet
- Transpirasi LaporanDocument13 pagesTranspirasi LaporanNanaNo ratings yet
- PROSES ROBEK DAUN PISANGDocument19 pagesPROSES ROBEK DAUN PISANGAndhyNo ratings yet
- OPTIMASI FOTOSINTESISDocument18 pagesOPTIMASI FOTOSINTESISIrvan Mahmudi100% (1)
- Komunitas VegetasiDocument13 pagesKomunitas VegetasiVera MelyandiniNo ratings yet
- ALBUM AMARANTHACEAEDocument53 pagesALBUM AMARANTHACEAEZainul Usman AliqNo ratings yet
- Fermentasi Substrat Padat untuk Produksi Enzim dan Bahan KimiaDocument3 pagesFermentasi Substrat Padat untuk Produksi Enzim dan Bahan KimiaFauzia Dara QonitaNo ratings yet
- Kontrol HidriliaDocument8 pagesKontrol HidriliaNeni AnggrainiNo ratings yet
- Laporan Pratikum BiologiDocument6 pagesLaporan Pratikum BiologiRozzin Fata UlwanNo ratings yet
- Macam Macam KlorofilDocument2 pagesMacam Macam KlorofilAngelicaLidyaNo ratings yet
- BIOSINTESIS KARBOHIDRATDocument13 pagesBIOSINTESIS KARBOHIDRATMiftakhul Huda50% (2)
- Karakteristik Mikroorganisme Prokariot dan EukariotikDocument50 pagesKarakteristik Mikroorganisme Prokariot dan EukariotikNadia EfendiNo ratings yet
- Leucaena GlaucaDocument2 pagesLeucaena GlaucaLili RNo ratings yet
- Mekanisme Masuknya Air Pada TumbuhanDocument10 pagesMekanisme Masuknya Air Pada TumbuhanSinta Handayani75% (4)
- Vektor KloningDocument10 pagesVektor KloningAgil Cendoll AnggaraNo ratings yet
- SELTUMBUHANDocument15 pagesSELTUMBUHANImaniarLeonytaMaulidia100% (1)
- LATAR BELAKANG Biji N LATAR BELAKANG Biji N KecambahKecambahDocument2 pagesLATAR BELAKANG Biji N LATAR BELAKANG Biji N KecambahKecambahTriHandoyoNo ratings yet
- ManfaatLempuyangDocument1 pageManfaatLempuyangSalma SalsabillaNo ratings yet
- Pengaruh Cahaya (Suhu) Terhadap Kecepatan TranspirasiDocument22 pagesPengaruh Cahaya (Suhu) Terhadap Kecepatan TranspirasiShilvi ShinhwaNo ratings yet
- Sistematika KapasDocument12 pagesSistematika KapasUlfa FitrianaNo ratings yet
- BUKU EKOLOGI TUMBUHAN (Terkompres)Document152 pagesBUKU EKOLOGI TUMBUHAN (Terkompres)putu yulitaNo ratings yet
- RespiraSimulasiDocument7 pagesRespiraSimulasisausanNo ratings yet
- Materi Kormus Dan Bagiannya - Kelompok 3Document16 pagesMateri Kormus Dan Bagiannya - Kelompok 3choi sandaraNo ratings yet
- An DaunDocument15 pagesAn DaunNasrugameNo ratings yet
- ParenkimTumbuhanDocument3 pagesParenkimTumbuhanSarwan HamidNo ratings yet
- Botani Buah 2Document3 pagesBotani Buah 2Miranda HelviraNo ratings yet
- Kunci Dikotomi Tomat MerahDocument3 pagesKunci Dikotomi Tomat Merahanisahamasah100% (1)
- Laporan Fisiologi Tumbuhan: Praktikum V Mengukur Kadar Klorofil Kembang Sepatu (Hibiscus Rosa-Sinensis)Document9 pagesLaporan Fisiologi Tumbuhan: Praktikum V Mengukur Kadar Klorofil Kembang Sepatu (Hibiscus Rosa-Sinensis)dimasNo ratings yet
- Laporan Praktikum Fisiologi Pohon - Karbohidrat Tanaman 2Document11 pagesLaporan Praktikum Fisiologi Pohon - Karbohidrat Tanaman 2adi parulian100% (1)
- SimplisiaDocument4 pagesSimplisiaasriNo ratings yet
- Bahan Makalah Bunga, Buah Dan BijiDocument31 pagesBahan Makalah Bunga, Buah Dan BijiAnisa FitriaNo ratings yet
- Perbedaan Pigmen Klorofil A Dan KlorofilDocument3 pagesPerbedaan Pigmen Klorofil A Dan KlorofilRatna PuspitaNo ratings yet
- Anatomi AkarDocument6 pagesAnatomi AkarHilal AbdullahNo ratings yet
- Lampiran 1 PKP2 Rekap Judul REVISIDocument243 pagesLampiran 1 PKP2 Rekap Judul REVISIMelda SartikaNo ratings yet
- Isi MakalahDocument8 pagesIsi MakalahRindaNo ratings yet
- Botani Tanaman Bawang MerahDocument41 pagesBotani Tanaman Bawang Merahameersabry0% (1)
- FOTOSINTESIS C4Document23 pagesFOTOSINTESIS C4Mita LarasatiNo ratings yet
- Benalu Kelompok 4Document5 pagesBenalu Kelompok 4reni munazirNo ratings yet
- Hubungan Bahan Organik Dan VegetasiDocument3 pagesHubungan Bahan Organik Dan Vegetasisilvia saniaNo ratings yet
- Perisikel Adalah Lapisan Terluar Dari Stele Yang Berperan Dalam Pertumbuhan Sekunder Dan Pertumbuhan Akar Ke SampingDocument23 pagesPerisikel Adalah Lapisan Terluar Dari Stele Yang Berperan Dalam Pertumbuhan Sekunder Dan Pertumbuhan Akar Ke SampingInsar Damopolii Tempoesekarang100% (1)
- Morfologi dan Karakteristik Gnetum gnemonDocument4 pagesMorfologi dan Karakteristik Gnetum gnemonDely Citra100% (1)
- Jamur Pada Tempe (Rhizopus oligosporusDocument12 pagesJamur Pada Tempe (Rhizopus oligosporusDidikDwiPrastyoNo ratings yet
- RESPON TANAMANDocument6 pagesRESPON TANAMANMade DeddyNo ratings yet
- Kultur Kalus untuk PenelitianDocument10 pagesKultur Kalus untuk PenelitianrizkiNo ratings yet
- Kimia Organologam Logam Blok DDocument5 pagesKimia Organologam Logam Blok DNova Echylestari AfganismeNo ratings yet
- Presentasi OrganologamDocument6 pagesPresentasi OrganologamIlham AjNo ratings yet
- Cooperative LearningDocument10 pagesCooperative LearningChilfanny SumantiNo ratings yet
- An Model AtomDocument10 pagesAn Model AtomChilfanny SumantiNo ratings yet
- Aldehid Dan KetonDocument10 pagesAldehid Dan KetonChilfanny SumantiNo ratings yet
- Jurnal Kinetika KimiaDocument10 pagesJurnal Kinetika KimiaChilfanny Sumanti100% (1)