Professional Documents
Culture Documents
Spektrum Atom Hidrogen
Uploaded by
Dede NurhasanahOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Spektrum Atom Hidrogen
Uploaded by
Dede NurhasanahCopyright:
Available Formats
Atom Hidrogen
Atom hidrogen terdiri dari sebuah proton yang berat dan relatif diam (biasanya ditemoatkan di titik pusat koordinat) yang bermuatan e, dan sebuah elektron yang lebih ringan (dengan muatan -e) yang berputar mengelilingi proton dalam sebuah orbit tertentu (lihat gambar 4.3). Dari hukum Coulomb, energi potensialnya adalah (dalam satuan SI) [4.52]
, dan persamaan radialnya (Persamaan 4.37) adalah [4.53] .
Gambar 4.3: Atom Hidrogen Tantangan kita kali ini adalah menyelesaikan persamaan ini untuk u(r) dan menghitung energi elektron E yang diijinkan. Atom hidrogen adalah sebuah kasus penting dalam mekanika kuantum yang mana kita akan menyelesaikannya secara detail dengan menggunakan metode yang telah digunakan dalam solusi analitik pada permasalahan osilator harmonik. (Jika setiap lagkah dalam proses ini kurang jelas, kamu bisa melihat kembali pada sesi 2.3.2 untuk penjelasan lebih lengkap.) Kebetulan sekali, potensial Coulomb (Persamaan 4.52) berlaku keadaan kontinu (dengan E > 0), yang menjelaskan hamburan elektron-proton, sebaik pada keadaan terikat diskret, yang merepresentasikan atom hidrogen, tetapi sebaiknya kita menahan perhatian kita mengenai hal ini untuk dibahas kemudian.
4.2.1 Fungsi Gelombang Radial
Tugas pertama kita adalah untuk merapikan notasi. Kita misalkan
[4.54]
(Untuk keadaan terikat, E < 0, maka dapatkan
bersifat real.) Pembagian Persamaan 4.53 dengan E, kita
. Dengan ini dianjurkan untuk memisalkan dengan [4.55]
, dan
Dengan permisalan tersebut, maka persamaan radial menjadi [4.56]
. Selanjutnya kita memanfaatkan bentuk asimtotik dari solusi. pada bagian dalam kurung kotak mendominasi, maka persamaan 4.56 menjadi [4.56] . Dari sini, solusi umumnya adalah [4.67] , tetapi, nilai menjadi tak berhingga pada , sehingga [4.58] . Dengan jelas, , kita asumsikan bahwa
untuk nilai yang sangat besar. Di sisi lain, pada , maka kali ini bagian sentrifugal yang mendominasi[1], maka kira-kira Persamaan 4.45 menjadi
. Solusi umumnya adalah (kamu bisa memeriksanya sendiri) , Tetapi bernilai tak berhingga pada , maka kita harus memilih (4.59) . Oleh karena itu
untuk nilai
yang kecil.
Langkah selanjutnya adalah menghilangkan perilaku asimptotik, untuk itu kita perkenalkan fungsi baru : [4.60] , Dengan harapan bahwa akan menjadi lebih sederhana dari pada . Walaupun indikasi pertamanya tidak menguntungkan kita, tetapi tidak apalah, mari kita kerjakan saja
, dan turunan keduanya adalah . Dalam bentuk , maka persamaan radial menjadi [4.61]
Akhirnya, kita bisa mengasumsikan bahwa solusi dalam : [4.62]
dapat diekspresikan sebagai deret pangkat
. Permasalahan kita sekarang adalah untuk menentukan koefisien Persamaan 4.62 terhadap adalah . Turunan pertama
[Dalam penjumlahan kedua kita telah menamakan ulang indeks durni: . Jika ini mengganggumu, tulislah ulang penjumlahan yang pertama secara lebih eksplisit, dan periksalah. Kamu mungkin berkata kalau penjumlahan seharusnya dimulai pada , tetapi faktor dapat menghilangkan permasalahan tersebut, sehingga kita bisa memulai penjumlahan sama seperti biasanya yaitu dimulai pada .] Penurunan lagi terhadap ,
. Dengan memasukkan ini ke dalam Persamaan 4.61 kita dapatkan . Dengan menyamakan koefisiennya berdasarkan pagkatnya menghasilkan
, atau [4.63]
. Rumusan rekursi ini menentukan nilai koefisien, dan karena itu fungsi dengan : kita mulai
(ini akan menjadi konstanta secara keseluruhan, yang akan ditentukan secepatnya , dengan
dengan menggunakan normalisasi), dan dari Persamaan 4.63 kita dapatkan menggunakan hasil ini kembali, kita akan memperoleh , demikian seterusnya.[2]
Sekarang, kita lihat seperti apa bentuk koefisiennya untuk nilai j yang besar (ini berhubungan dengan nilai yang besar pula, di mana didominasi oleh pangkat yang terbesar). Dalam daerah ini, formula rekursi menjadi
, sehingga
[4.64]
. Untuk saat ini anggap saja ini adalah solusi eksaknya. Maka
, dan oleh sebab itu [4.65]
, yang akan menjadi tak berhingga pada yang besar. Eksponensial positif tentunya adalah perilaku asimptotik yang tidak kita inginkan dalam Persamaan 4.57. (Ini bukanlah suatu kebetulan bahwa ini akan muncul lagi disini, ini mencerminkan bentuk asimptotik pada beberapa solusi persamaan radial, itu hanya tidak menjadi satu seperti apa yang kita inginkan, karena tidak ternormalisasi.) hanya ada satu cara untuk keluar dari dilema ini: deret haruslah berhenti. Harus terjadi pada suatu nilai integer maksimal, , seperti di bawah ini [4.66]
(dan koefisien yang berada diluar ini akan hilang dengan sendirinya). Dengan jelas (Persamaan 4.63) . Definisikan [4.67]
(yang dinakamakan dengan bilangan kuantum utama), kita punya [4.68] . Karena menentukan nilai E (Persamaan 4.54 dan 4.55):
[4.68] , maka energi yang diijjinkan adalah [4.70] , dengan .
Ini adalah formula Bohr yang terkenal-hasil yang paling penting dari setiap pengukuran dalam mekanika kuantum. Bohr mendapatkannya pada 1913 yang mana tidak dapat diterapkan dalam fisika klasik dan awal-awal kelahiran teori kuantum (Persamaan Shroedinger belum muncul hingga tahun 1924). Pengkombinasian Persamaan 4.55 dan 4.68 kita dapatkan bahwa [4.71]
, di mana [4.72]
adalah jari-jari Bohr. Ini berlanjut (dari Persamaan 4.55 lagi) bahwa [4.73]
Dengan jelas bahwa fungsi gelombang spasial untuk atom hodrogen ditandai dengan tiga bilangan kuantum (n, l, dan m): [4.74] , di mana (merujuk kembali pada Persamaan 4.36 dan 4.60) [4.75] ,
dengan adalah polynomial pada sudut dalam , yang koefisiennya ditentukan oleh formula rekursi (hingga pada faktor normalisasi keseluruhan) [4.76] .
Keadaan dasarnya (ground state) adalah pada yang memiliki energi yang paling rendah, dengan meletakkan ini pada konstanta fisis, kita dapatkan [4.77]
. Dengan jelas energi ikat atom hidrogen (nilai energi yang harus diberikan pada elektron untuk mengionisasi atom) adalah 13,6 eV. Persamaan juga (lihatlah Persamaan 4.29), sehingga [4.78] . Formula dengan rekursi terpotong setelah menghasilkan ), sehingga bagian yang pertama (Persamaan adalah sebuah konstanta ( ) dan [4.79] . Dengan menormalisasikannya, yang sesuai dengan Persamaan 4.31, , sehingga . Sementara itu, , maka [4.80] . Jika , energinya adalah [4.81] 4.76 4.67 menghendaki , yang mana
; Ini adalah keadaan tereksitasi yang pertama, atau baiknya, suatu keadaan dimana kita memiliki (dengan ) atau (dengan atau ), sehingga sebenarnya terdapat empat keadaan berbeda yang berbagi energi ini. Jika , formula rekursi (Persamaan 4.76) memberikan (menggunakan Maka , dan karenanya [4.82] . Jika , formula rekursi mengakhiri deret pada bagian pertama ( konstanta ( ), dan kita dapatkan [4.83] . [pada setiap kasus dihitung dengan menggunakan normalisasi, lihatlah soal 4.11.] ), maka ( ) adalah sebuah ), dan (menggunakan ),
Untuk sembarang , nilai yang mungkin adalah (konsisten dengan Persamaan 4.67) adalah [4.84] . Untuk masing-masing , terdapat degenerasi level energi total adalah nilai yang mungkin (Persamaan 4.29), sehingga
[4.85] . Polynomial (didefinisikan oleh formula rekursi, Persamaan 4.76) adalah sebuah fungsi yang dikenal dengan baik oleh matemamatikawan terapan, terpisah dari normalisasi dapat dituliskan sebagai [4.86] ,
di mana
adalah polynomial Laguerre terasosiasi, dan [4.88]
adalah polynomial Laguerre ke-q.[3] (beberapa polynomial ditampilkan dalam Tabel 4.4. beberapa polynomial Laguerre terasosiasi diberikan dalam Tabel 4.5. Beberapa fungsi gelombang radial ditampilkan dalam Tabel 4.6 dan sketsa grafiknya dapat dilihat dalam Gambar 4.4.) Normalisasi fungsi gelombang atom hydrogen adalah[4] [4.89] . Sebenarnya ini tidaklah mencerminkan keadaan nyata secara benar, tetapi Ini adalah salah satu dari beberapa sistem yang paling realistis yang dapat diselesaikan hingga saat ini dalam bentuk yang eksak. Itu juga bersifat orthogonal yang akan kita buktikan kemudian Tabel 4.4: Beberapa polinomial laguerre, .
Tabel 4.5: beberapa polynomial Laguerre terasosiasi,
Tabel 4.6: Beberapa fungsi gelombang radial atom hidrogen,
[4.90] .
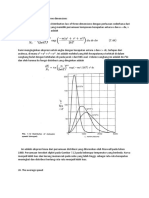
Gambar 4.4: Grafik dari beberapa fungsi gelombang radial atom hydrogen,
4.2.2 Spektrum Hidrogen
Pada prinsipnya, jika kita meletakkan atom hidrogen pada suatu keadaan stasioner , seharusnya akan berada di situ selamanya. Bagaimanapun juga, jika kamu menggnggunya sedikit (menumbukkan dengan atom lain, atau dengan menyinarkan cahaya padanya), maka atom mungkin akan berpindah ke keadaan stasioner lain, salah satunya dengan menyerap energi dan bergerak menuju keadaan energi yang lebih tinggi, atau dengan melepaskan energi (biasanya dalam bentuk radiasi elektromagnetik) dan bergerak menuju keadaan energi yang lebih rendah.[5] Dalam prakteknya seperti gangguan selalu ada, transisi (atau yang biasa dinamakan dengan lompatan kuantum) pasti akan terjadi, dan hasilnya adalah bahwa sekumpulan atom hidrogen melepaskan cahaya (foton), di mana energinya berhubungan dengan perbedaan energi antara keadaan awal dan akhir: [4.91]
. Sekarang, berdasarkan formula Planck[6] energi foton adalah proporsional dengan frekuensinya: [4.92] .
Sementara itu, panjang gelombangnya diberikan oleh [4.93]
, sehingga
, di mana [4.94] . R dikenal dengan konstanta Rydberg, dan Persamaan 4.93 adalah formula Rydberg untuk spektrum atom hidrogen. Itu ditemukan secara empiris pada abad ke-19, dan merupakan kemenangan terbesar dari teori Bohr adalah kemampuannya dalam menghitung hasil ini, dan untuk menghitung R dalam bentuk konstanta dasar dalam ilmu pasti. Transisi menuju keadaan dasar ( ) berada dalam jangkauan ultraviolet, yang dikenal oleh para spketrokopis sebagai deret Lyman. Transisi menuju keadaan tereksitasi pertama ( ) jatuh pada daerah cahaya tampak, yang merupakan deret Balmer. Transisi me menuju (Deret Paschen) terjadi dalam inframerah, dan seterusnya (lihat Gambar 4.5). (Pada suhu ruangan, kebanyakan atom hidrogen berada pada keadaan dasar, untuk mendapatkan spektrum emisi, kita harus menaikkannya pada keadaan tereksitasi, biasanya ini terjadi dengan melewatkan cetusan api elektrik pada gas.)
[1]Argumen ini tidak dapat diaplikasikan ketika (walaupun hasil akhirnya, Persamaan 4.59 sesuai untuk kasus tersebut). Tetapi tidak apalah, semua yang kita coba sebenarnya adalah untuk menyajikan beberapa motivasi untuk mengubah variabelya (Persamaan 4.60). [2]Kamu mungkin heran kenapa kita tidak langsung menggunakan metode deret secara langsung pada ? Mengapa harus memasukkan faktor asimptotik sebelum mengaplikasikan prosedur ini? Alasanya adalah untuk menghilangkan faktor , di mana itu adalah faktor estetik: tanpa ini, kita akan mendapatkan serangkaian deret panjang nol (koefisien bukan nol pertama berada pada ), dengan menghilangkan faktor kita mendapatkan deret yang dimulai dengan . Faktor lebih genting lagi, jika kamu tidak menghilangkan faktor ini, kamu akan mendapatkan tiga bentuk formula rekursi yang terdapat , , dan (cobalah), dan kita akan sangat kesulitan mengerjakan ini. [3]Seperti biasanya, terdapat lawan dari kaidah normalisasi dalam literature, saya tealah menggunakan yang paling dekat dengan standar. [4]Jika kamu ingin mengetahui bagaimana faktor normalisasi dihitung, pelajari (sebagai contoh), L. Schiff, Quantum Mechanics, 2nd ed. (New York: McGraw-Hill, 1968), halaman 93.
[5]Secara alami, ini melibatkan interaksi kebergantungan waktu, dan mekanisme detilnya akan dibahas segera dalam BAB 9, untuk kali ini mekanisme aktualnya tidak penting. [6]Foton adalah radiasi elektromagnetik kuantum, ini adalah objek relativistik, dan untuk itu ini berada diluar ranah yang kita pelajari, mekanika kuantum nonrelativistik. Namun ini sangat berguna untuk membicarakan foton dan melibatkan formula Planck untuk energinya, tetapi simpan saja di pikiranmu karena ini berada di luar teori yang sedang kita kembangkan. [7]Untuk lebih jelasnya, silahkan lihat Boas (catatan kaki 2), BAB 5 Sesi 4. [8]Faktor normalisasi didapatkan dari soal 4.47. Faktor dipilih untuk konsistensi dengan notasi yang akan kita gunakan dalam teori momentum anguler dan ini merupakan standar yang cukup beralasan, walaupun beberapa buku yang lebih lama menggunkan konvensi yang lama. Ingat bahwa:
[9]Simbol m disini menunjukkan massa, tentunya kita tidak akan menemukan bilangan kuantum m dalam persamaan Radial. [10]Sebenarnya, semua yang kita butuhkan adalah bahwa fungsi gelombang haruslah ternormalisasi,bukan hanya yang terbatas pada pada titik pusat seharusnya ternormalisasi (karena faktor dalam persamaan 4.31). Untuk bukti yang lebih jelas bahwa B=0, lihat R. Shankar, Principles of Quantum Mechanics (New York: Plenum, 1980), halaman 351.
You might also like
- Osilator HarmonikDocument14 pagesOsilator HarmonikMetha Bouvier SianturiNo ratings yet
- Prinsip Ketaktentuan Dan Sifat GelombangDocument36 pagesPrinsip Ketaktentuan Dan Sifat GelombangPrimadi GayuhNo ratings yet
- Bab 4 Persamaan Gelombang Relativistik PDFDocument40 pagesBab 4 Persamaan Gelombang Relativistik PDFsulfiantyNo ratings yet
- Atom HidrogenDocument7 pagesAtom HidrogenabdulNo ratings yet
- Partikel Dalam Kisi Satu DimensiDocument6 pagesPartikel Dalam Kisi Satu DimensiDaeng Papekang GfiNo ratings yet
- Atom HidrogenDocument29 pagesAtom HidrogenEva MeutiaNo ratings yet
- 2.4 GriffithDocument3 pages2.4 GriffithRia Meidahrianti ANo ratings yet
- Mekflu Bab 4 - Muhammad Safiq - 1910913042Document39 pagesMekflu Bab 4 - Muhammad Safiq - 1910913042Muhammad SsNo ratings yet
- PERSAMAAN SCHRöDINGERDocument22 pagesPERSAMAAN SCHRöDINGERFakhri Abdullah RosyidNo ratings yet
- Distribusi MaxwellDocument4 pagesDistribusi MaxwelladhelaNo ratings yet
- Analisis FourierDocument18 pagesAnalisis FourierAlif AkbarNo ratings yet
- Atom HidrogenDocument28 pagesAtom HidrogenKrisna SinghNo ratings yet
- Persamaan SchrodingerDocument34 pagesPersamaan SchrodingerKrisna Singh100% (2)
- Makalah Fisika KuantumDocument48 pagesMakalah Fisika KuantumMulyaRahmawatiNo ratings yet
- Osilator HarmonikDocument34 pagesOsilator HarmonikGuruh Sukarno PutraNo ratings yet
- Fungsi Gelombang dan Harga EkspektasiDocument42 pagesFungsi Gelombang dan Harga EkspektasiJuwita ExoNo ratings yet
- Quantum Osilator HarmonikDocument11 pagesQuantum Osilator HarmonikDaeng Papekang GfiNo ratings yet
- Bab 4Document13 pagesBab 4Mawardhany PutriNo ratings yet
- Bilangan Kuantum (Soal)Document6 pagesBilangan Kuantum (Soal)sitaNo ratings yet
- Desti Armelia Fitri - 17033054 - Fismod - Teori Kuantum Atom HidrogenDocument32 pagesDesti Armelia Fitri - 17033054 - Fismod - Teori Kuantum Atom HidrogenDESTI ARMELIA FITRINo ratings yet
- Perhitungan Fungsi Gelombang (Bentuk Orbital 2px Atom Karbon)Document20 pagesPerhitungan Fungsi Gelombang (Bentuk Orbital 2px Atom Karbon)Muhammad Yusi Anda Rizky100% (2)
- Osilator Harmonik KuantumDocument13 pagesOsilator Harmonik KuantumIka D' SanguinsNo ratings yet
- BAB V Mekanika KuantumDocument8 pagesBAB V Mekanika KuantumJamie KellerNo ratings yet
- TUGAS KELOMPOK 10 - Sri Andra Yufa - Yuli Indah PermataDocument8 pagesTUGAS KELOMPOK 10 - Sri Andra Yufa - Yuli Indah PermataUci RahmaddaniiNo ratings yet
- Kapasitas Kalor KristalDocument10 pagesKapasitas Kalor KristalZaenal T. ArifinNo ratings yet
- Makalah Persamaan SchrodingerDocument21 pagesMakalah Persamaan SchrodingerMuhammad IrvanNo ratings yet
- MEKANIKA KUANTUMDocument22 pagesMEKANIKA KUANTUMfitratul fajrinNo ratings yet
- MekstatDocument19 pagesMekstatDestriayu VasistaNo ratings yet
- Matematika Teknik Osilasi Dipakai ResonansiDocument13 pagesMatematika Teknik Osilasi Dipakai ResonansianismahardikaNo ratings yet
- Mekanika Klasik - Gerakan Partikel 3 DimensiDocument48 pagesMekanika Klasik - Gerakan Partikel 3 DimensiEna Nurfalah R100% (1)
- Kel.2 - PPT Elemen Mekanika KuantumDocument30 pagesKel.2 - PPT Elemen Mekanika Kuantumharun yahya ayashNo ratings yet
- GERAK 3DDocument23 pagesGERAK 3DTika WahyuniNo ratings yet
- Persamaan SchrodingerDocument42 pagesPersamaan SchrodingerDian galuhNo ratings yet
- Tugas Pertemuan 4Document3 pagesTugas Pertemuan 4Meli mulianaNo ratings yet
- Makalah Reaksi NuklirDocument17 pagesMakalah Reaksi NuklirvatavataNo ratings yet
- Fisika ModernDocument29 pagesFisika ModernJumainahNo ratings yet
- Teori GangguanDocument30 pagesTeori GangguanRif'atur Rohmah100% (1)
- Persamaan Schrodinger Pada Tanggul PotensialDocument6 pagesPersamaan Schrodinger Pada Tanggul PotensialM Danial Fikri Alhusain100% (2)
- Orbital Molekul H2ODocument8 pagesOrbital Molekul H2OAgung PerdanaNo ratings yet
- Gaya Sentral Dan Mekanika AstronomiDocument13 pagesGaya Sentral Dan Mekanika AstronomiPutra Hasibuan0% (1)
- Makalah Persamaan SchrodingerDocument14 pagesMakalah Persamaan SchrodingerifranNo ratings yet
- Difusi Dan Propagasi ElektromagnetikDocument21 pagesDifusi Dan Propagasi ElektromagnetikAnjazumaki AufaNo ratings yet
- PDF Chapter 4 New CompressDocument20 pagesPDF Chapter 4 New CompressScri BDNo ratings yet
- PDF Chapter 4 New CompressDocument20 pagesPDF Chapter 4 New CompressScri BDNo ratings yet
- Gaya Sentral pada Buku Mechanics Third EditionDocument28 pagesGaya Sentral pada Buku Mechanics Third EditionangieNo ratings yet
- Makalah Model Atom BohrDocument16 pagesMakalah Model Atom BohrRifky Indra PrasetiaNo ratings yet
- Thermal FononDocument32 pagesThermal FononSatria Auffa Dhiya UlhaqueNo ratings yet
- Fisika IntiDocument11 pagesFisika IntiLailiatul MuawanahNo ratings yet
- Geodesi Fisis LaplaceDocument13 pagesGeodesi Fisis LaplaceEga Gumilar HafizNo ratings yet
- Kimfis 3Document4 pagesKimfis 3HudiaNo ratings yet
- MEKANIKA KUANTUMDocument24 pagesMEKANIKA KUANTUMOhmSoeprapto0% (1)
- Persamaan DiferensialDocument18 pagesPersamaan DiferensialMeila handainiNo ratings yet
- Makalah Seminar (Persamaan Maxwell)Document11 pagesMakalah Seminar (Persamaan Maxwell)Алпианор0% (1)
- Tugas Makalah-Wa Ode Dewinda (A1k120031)Document15 pagesTugas Makalah-Wa Ode Dewinda (A1k120031)IndahNo ratings yet
- Spektrum AtomDocument7 pagesSpektrum AtomAnggie Pravita RamadhanaNo ratings yet
- Properti Dari Transformasi LaplaceDocument11 pagesProperti Dari Transformasi Laplaceaurora azaleaNo ratings yet
- AssalamuDocument5 pagesAssalamuDede NurhasanahNo ratings yet
- ArtikelDocument3 pagesArtikelDede NurhasanahNo ratings yet
- AssalamuDocument5 pagesAssalamuDede NurhasanahNo ratings yet
- Aku Menunggumu Duhai Calon PendampingkuDocument1 pageAku Menunggumu Duhai Calon PendampingkuDede NurhasanahNo ratings yet