Professional Documents
Culture Documents
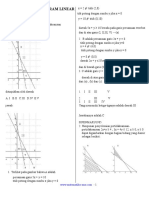
Bab 5
Uploaded by
Zeca Pereira0 ratings0% found this document useful (0 votes)
41 views14 pagesCopyright
© Attribution Non-Commercial (BY-NC)
Available Formats
PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Attribution Non-Commercial (BY-NC)
Available Formats
Download as PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
41 views14 pagesBab 5
Uploaded by
Zeca PereiraCopyright:
Attribution Non-Commercial (BY-NC)
Available Formats
Download as PDF, TXT or read online from Scribd
You are on page 1of 14
You might also like
- Soal Pat Tik Kelas 8 2020Document4 pagesSoal Pat Tik Kelas 8 2020SMK AL JIHADNo ratings yet
- Contoh Soal Dan Jawaban Bahasa Indonesia Kelas 7 Semester 1Document7 pagesContoh Soal Dan Jawaban Bahasa Indonesia Kelas 7 Semester 1Dayzie AndryNo ratings yet
- Ciri2 Benua AntartikaDocument2 pagesCiri2 Benua AntartikaWuri CahyaningrumNo ratings yet
- Rangkuman PKN Kls 8 Semester 2 Bab Kedaulatan RakyatDocument2 pagesRangkuman PKN Kls 8 Semester 2 Bab Kedaulatan RakyatTri Firmansyah100% (4)
- Kelebihan Dan Kekurangan Masing TriadeDocument4 pagesKelebihan Dan Kekurangan Masing TriadeRiga 'Azoe' AlrianiNo ratings yet
- PG SOSIOLOGI XIbDocument32 pagesPG SOSIOLOGI XIbAmalia KhofifahNo ratings yet
- Soal Paket 5 FisikaDocument10 pagesSoal Paket 5 FisikaSuci Hidayanti20No ratings yet
- Konflik SampangDocument17 pagesKonflik Sampangshafa putri rahmadinaNo ratings yet
- Resensi Novel "Ayahku (Bukan) Pembohong"Document3 pagesResensi Novel "Ayahku (Bukan) Pembohong"YOGIE XG100% (1)
- Ulangan Harian BAB 2 PKNDocument4 pagesUlangan Harian BAB 2 PKNakriditasi smp50No ratings yet
- SOAL PAS IPA KLS 9 K13 - Ppi 88Document3 pagesSOAL PAS IPA KLS 9 K13 - Ppi 88Ina SeptianaNo ratings yet
- Merinci Bagian-Bagian Struktur Teks Deskripsi, Menentukan Bagian Identifikasi Dan Deskripsi Bagian Pada Teks Deskripsi Yang DisajikanDocument37 pagesMerinci Bagian-Bagian Struktur Teks Deskripsi, Menentukan Bagian Identifikasi Dan Deskripsi Bagian Pada Teks Deskripsi Yang DisajikanRahmat SutomoNo ratings yet
- Latsol PKN LengkapDocument48 pagesLatsol PKN LengkapDevina Aliffia100% (1)
- Soal P1 Latihan USBN PKN SMp-MTsDocument8 pagesSoal P1 Latihan USBN PKN SMp-MTsAgathaReginaNo ratings yet
- Ipa SMP 8 S2 B11 Rita PurwantiDocument22 pagesIpa SMP 8 S2 B11 Rita PurwantiElvia DesiNo ratings yet
- Materi Ipa Kelas 9 Bab 4 Listrik Statis 1604454398Document15 pagesMateri Ipa Kelas 9 Bab 4 Listrik Statis 1604454398Wiji MaharaniNo ratings yet
- Soal Akm Literasi Paket BDocument59 pagesSoal Akm Literasi Paket BFebe TrifenaNo ratings yet
- Soal Agama Kristen XDocument2 pagesSoal Agama Kristen XThomas Siagian100% (2)
- BAB 7 Dunia Tumbuhan (Plantae)Document93 pagesBAB 7 Dunia Tumbuhan (Plantae)Rizki KurniawanNo ratings yet
- Kimia BG KLS XIDocument240 pagesKimia BG KLS XIDyan SeptyaningsihNo ratings yet
- Sumber-Sumber Untuk Mengenal Yesus: Kementerian Pendidikan, Kebudayaan, Riset, Dan Teknologi Republik Indonesia, 2021Document48 pagesSumber-Sumber Untuk Mengenal Yesus: Kementerian Pendidikan, Kebudayaan, Riset, Dan Teknologi Republik Indonesia, 2021Elias Roy SimpuruNo ratings yet
- Soal Eksponen Untuk Google FormulirDocument4 pagesSoal Eksponen Untuk Google FormulirIda RahmawatiNo ratings yet
- Pidato Bahasa IndonesiaDocument2 pagesPidato Bahasa IndonesiaRizZty MeNnelz TogetherforeverNo ratings yet
- Kliping Luas BenuaDocument5 pagesKliping Luas BenuaGuntjoro NingratNo ratings yet
- Program LinearDocument9 pagesProgram LinearRapliNo ratings yet
- Bentuk Viru1Document1 pageBentuk Viru1Handika AntasaNo ratings yet
- SOAL DAN JAWABAN OSN Fisika SMA 2019Document46 pagesSOAL DAN JAWABAN OSN Fisika SMA 2019setyobrNo ratings yet
- Pedoman PenskoranDocument4 pagesPedoman PenskoranAriny ZaqiyahNo ratings yet
- B.Indo 2013 SMP OKAYDocument10 pagesB.Indo 2013 SMP OKAYIwan100% (1)
- 7 Nama OrganisasiDocument2 pages7 Nama OrganisasiNaila Muazara UlfaNo ratings yet
- Soal PAS IPS Kelas 8 K13Document4 pagesSoal PAS IPS Kelas 8 K13mts darulinayahNo ratings yet
- AfshjswowoiwbwbwDocument3 pagesAfshjswowoiwbwbwBrigitte CornellaNo ratings yet
- Panduan Siswa SMAK Satya CendikaDocument52 pagesPanduan Siswa SMAK Satya CendikaFransiskus X.D100% (1)
- (Kelompok 4) Makalah Sejarah Perjuangan Mewujudkan Kembali Negara Kesatuan RiDocument11 pages(Kelompok 4) Makalah Sejarah Perjuangan Mewujudkan Kembali Negara Kesatuan RiMuhammad Guntur FajriNo ratings yet
- Tugas2Wirus MayaDocument2 pagesTugas2Wirus Mayasyarifah maya0% (1)
- Materi Kimia Kls X Semester 1 Bab 3Document5 pagesMateri Kimia Kls X Semester 1 Bab 3-Nduuh Newbie-No ratings yet
- Soal Kimia Pas Ganjil Kelas XDocument7 pagesSoal Kimia Pas Ganjil Kelas XNasihNo ratings yet
- Kisah Berbakti Kepada Orang TuaDocument4 pagesKisah Berbakti Kepada Orang TuafirdausNo ratings yet
- KMD X MidDocument3 pagesKMD X Midparmo joNo ratings yet
- Kisi Kisi PAS PAIDocument4 pagesKisi Kisi PAS PAISurya Anastasya KastariNo ratings yet
- X Sejarah Indonesia KD 3.5 FinalDocument26 pagesX Sejarah Indonesia KD 3.5 FinalYulianto Wahyu SaputraNo ratings yet
- Rangkuman Bupena Kls 6 Tema 1 - 5 (1) BARUDocument82 pagesRangkuman Bupena Kls 6 Tema 1 - 5 (1) BARUYeni Rahmawati100% (1)
- Hasil Resensi Buku JKDocument11 pagesHasil Resensi Buku JKega100% (1)
- Jawaban PTS Ganjil Fisika X IIS (Jamilatus Sholihah)Document3 pagesJawaban PTS Ganjil Fisika X IIS (Jamilatus Sholihah)Setiadi NurzamanNo ratings yet
- KLS 12 Ujian Sekolah Agama Kristen 2021Document10 pagesKLS 12 Ujian Sekolah Agama Kristen 2021madren alexanderNo ratings yet
- Um-Ips-2022Document8 pagesUm-Ips-2022Samsul KhairNo ratings yet
- Bahan Pelajaran Kimia Sem 2 Kelas 10Document21 pagesBahan Pelajaran Kimia Sem 2 Kelas 10Fendy FendyNo ratings yet
- Teks Eksplanasi AbcdefghijkDocument46 pagesTeks Eksplanasi AbcdefghijkAvemaris LevanyaNo ratings yet
- Tema Seni Rupa MurniDocument3 pagesTema Seni Rupa MurniCausalia SithaNo ratings yet
- MTKP 46 Kls 11Document22 pagesMTKP 46 Kls 11Hestiani putriNo ratings yet
- Bab 4 Unit 1Document7 pagesBab 4 Unit 1Mi liNo ratings yet
- Ikatan Kimia FixDocument14 pagesIkatan Kimia FixSridevi SetiawatiNo ratings yet
- Kimia Organik 1Document87 pagesKimia Organik 1MarzelinaNo ratings yet
- Ringkasan KimiaDocument20 pagesRingkasan KimiaMade Teja SutresnaNo ratings yet
- Tugas 2 Kimia DasarDocument9 pagesTugas 2 Kimia DasarZall100% (7)
- Ikatan KovalenDocument4 pagesIkatan KovalenHaliimah Sa'diyahNo ratings yet
- Ikatan KovalenDocument6 pagesIkatan KovalenAriey PezexNo ratings yet
- Makalah Ikatan Kovalen (Struktur Oktet)Document11 pagesMakalah Ikatan Kovalen (Struktur Oktet)bowo azzaNo ratings yet
- Bab5 Ikatan Kimia A4Document9 pagesBab5 Ikatan Kimia A4Karsadi SaminNo ratings yet
- Ikatan KimiaDocument39 pagesIkatan Kimiaanisa 29032017No ratings yet